アジレクト錠1mg・0.5mg 発売中
Parkinson’s Disease Therapeutic Symposium 2022


Opening Remarks 野元 正弘 先生 済生会今治医療福祉センター センター長
本年のシンポジウムは実地での開催を企画していたが、新型コロナウイルス感染症の第6波のため、残念ながらリモートでの開催となった。われわれの大学での講義についても、この2年間は大部分がリモートになっているが、最近、学生の卒業試験の成績をコロナ禍の前と以降で比較したところ、ほとんど差がないという結果であった。中学校や高校を対象とした調査でも同様の結果が報告されているようである。よって、特に座学に関してはリモートでの教育が有用と考えられ、今後の教育や学術集会はハイブリッドでの実施が推進されると思われる。
神経学では実地での診察と検討が重要であるが、動画を含めてメディアを活用したハイブリッドな情報伝達は現状に適した取り組みと考えられる。
本日のシンポジウムはリモート開催であるが、パーキンソン病患者さんのQOLをいかに考慮するかに関して、活発な議論が行われることを期待する。
講演1 PDリハビリテーションの最新知見 -理論から実践まで-


パーキンソン病(PD)におけるリハビリテーション
PDのような神経変性疾患におけるリハビリテーションには、一般的な障害や先天性疾患などによって喪失あるいは低下した精神・身体機能を取り戻す取り組みに加え、疾患の進行抑制や症状悪化の抑制といった予防的な意味合いも含まれている。また、現在の精神・身体機能を維持することで、社会参加や就学、就労などを継続することが大きな目標となることも多い。
本日は、PD患者さんに対する運動療法によるリハビリテーションについて、最新の知見をご紹介する。
運動療法による効果発現機序
PDについては、さまざまなリスク因子と保護因子が知られているが、身体活動はPDのリスクや症状の改善をもたらす因子の1つとされている。軽度または中等度以上の運動は、脳由来神経栄養因子(Brain-derived neurotrophic factor:BDNF)の発現増加をはじめとする多くの機序を介し、運動症状とともにPDの非運動症状である抑うつや認知機能障害などの症状にも良い影響を与える(図1)1)。また、PD患者さん12例を対象とした検討では、中等度の運動を週3回、8週間実施することによりPD症状の評価スコアであるUPDRSが有意に改善(p=0.01、Wilcoxonの符号順位検定)すると同時に、血中のBDNF濃度が有意に上昇(p=0.34、Wilcoxonの符号順位検定)したことが示されている2)。
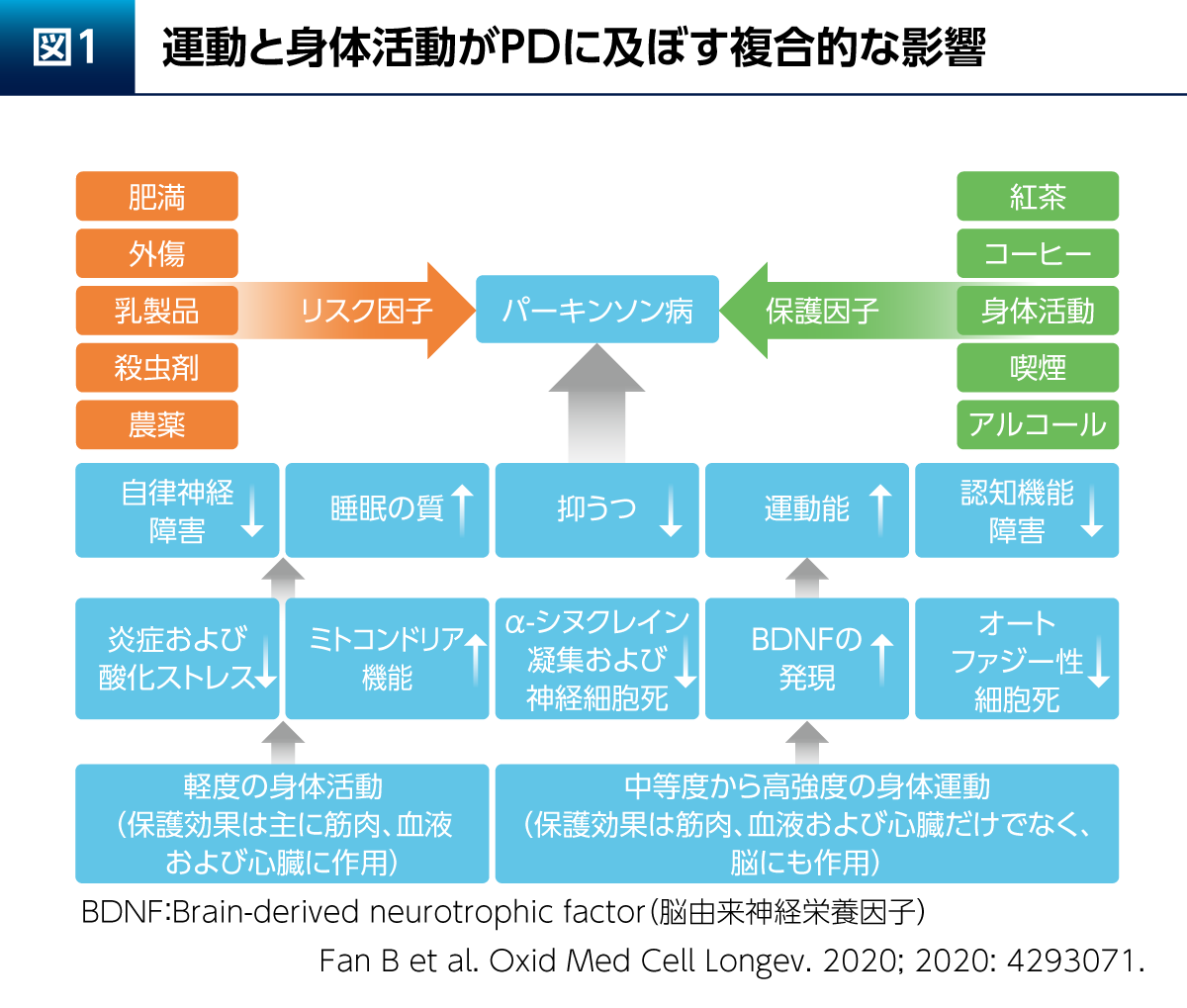
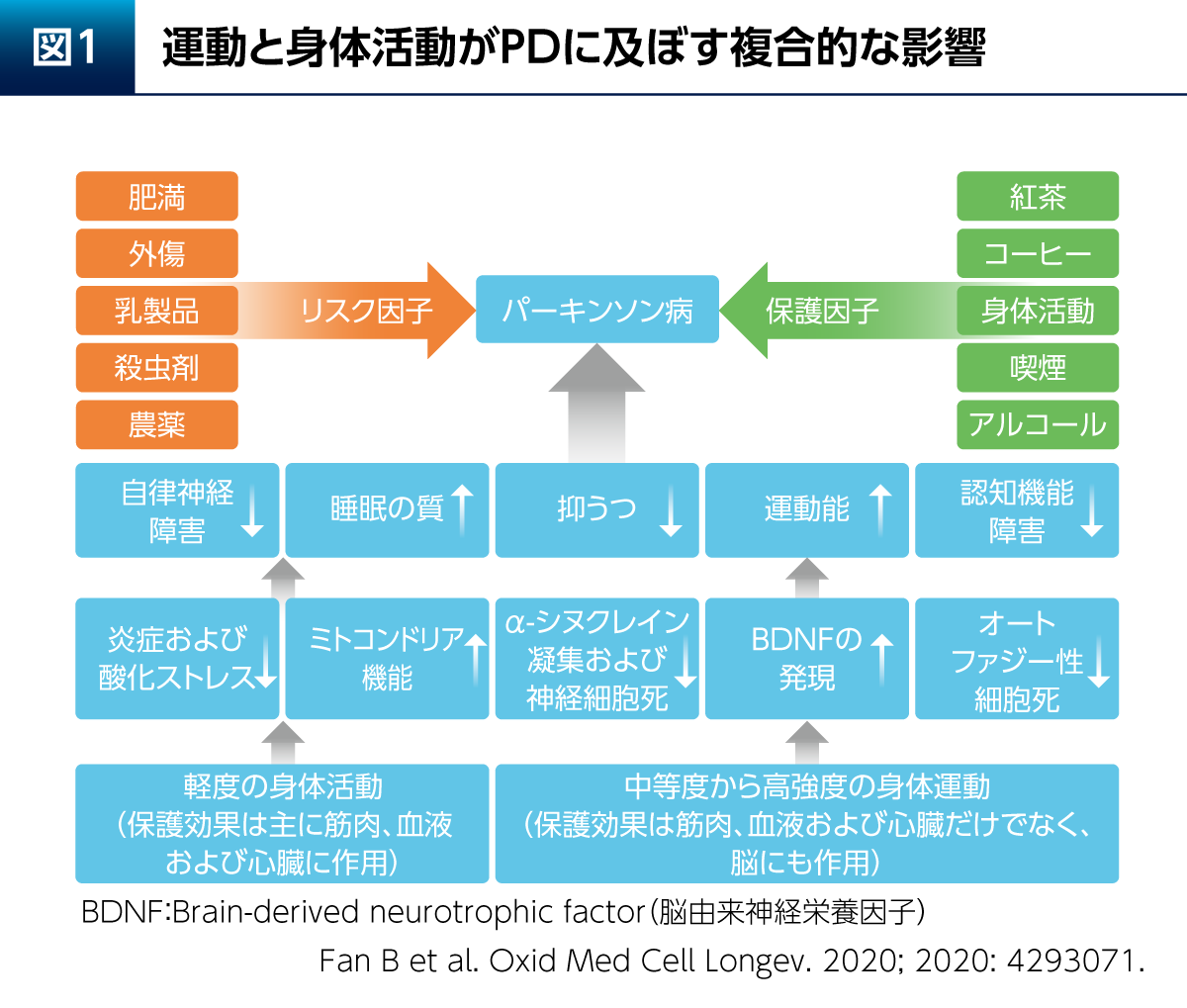
もっとも、運動療法によりヒトの脳内でどのような変化が起こるのかを検討することは難しい。そこで、動物実験による多くの検討が行われている。PDモデルラットを用いた検討からは、運動によって線条体および黒質のチロシン水酸化酵素(Tyrosine hydroxylase:TH)陽性細胞脱落が抑制され(p<0.05、Mann-WhitneyのU検定)、線条体におけるBDNFとグリア細胞株由来神経栄養因子(Glial cell line-derived neurotrophic factor:GDNF)の発現量が増加する(p<0.05、Mann-WhitneyのU検定)ことが報告されている3)。また、PDモデルマウスを用いた検討からは、運動による脳内ミトコンドリアへの保護的な影響や4)、α-シヌクレイン凝集(オリゴマー化)の抑制(p<0.01、t検定)および運動・認知機能への影響などが報告されている5)。さらに、運動のドパミン系以外の経路への影響も考えられ、PDはセロトニン系の障害も関与していることが知られているが6)、運動(トレッドミル歩行)によってラットの脳内セロトニン濃度は上昇することが報告されている(p< 0.05 : Fischer PLSDを用いた反復測定分散分析)7)。
運動・リハビリテーションによる短期的効果
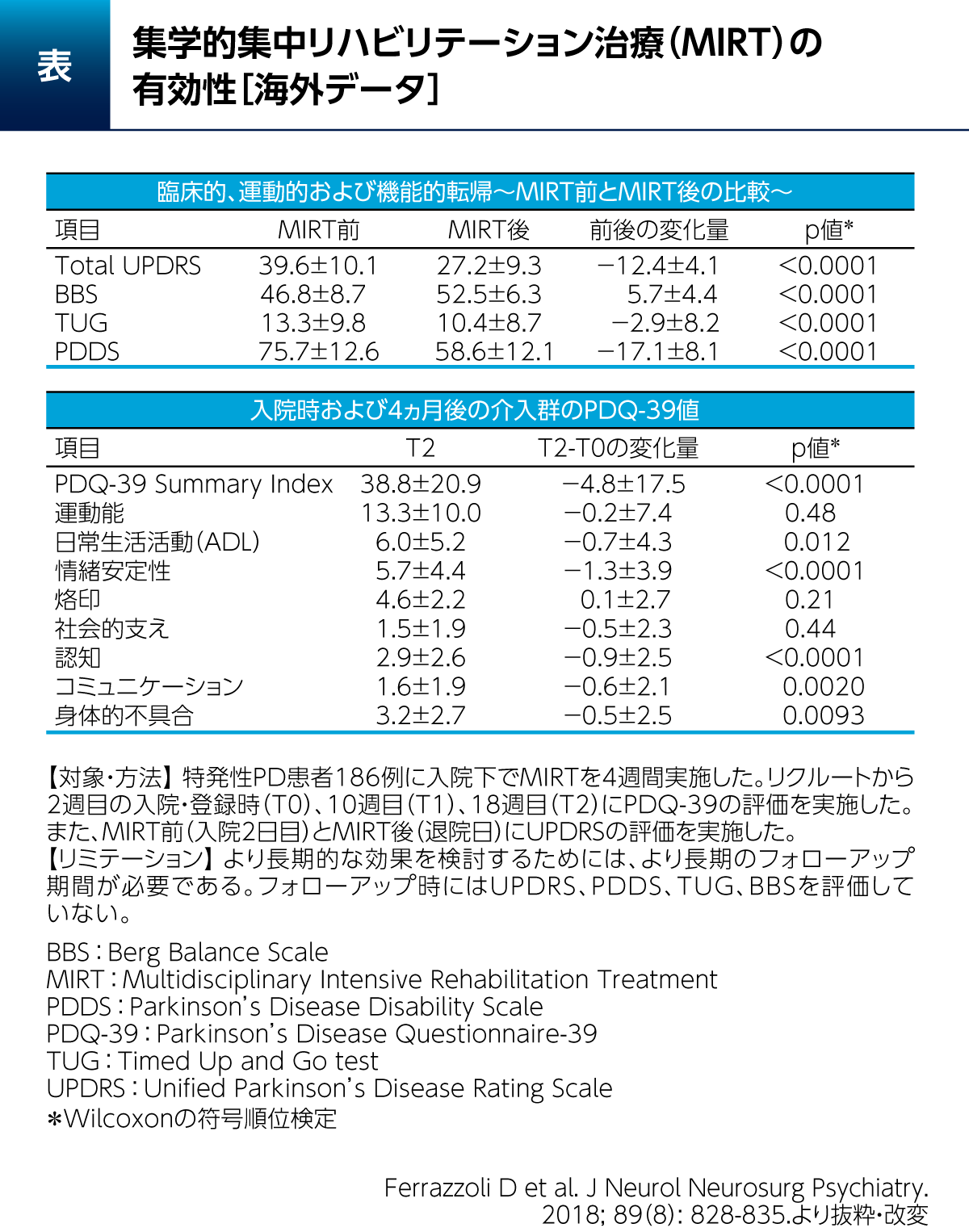
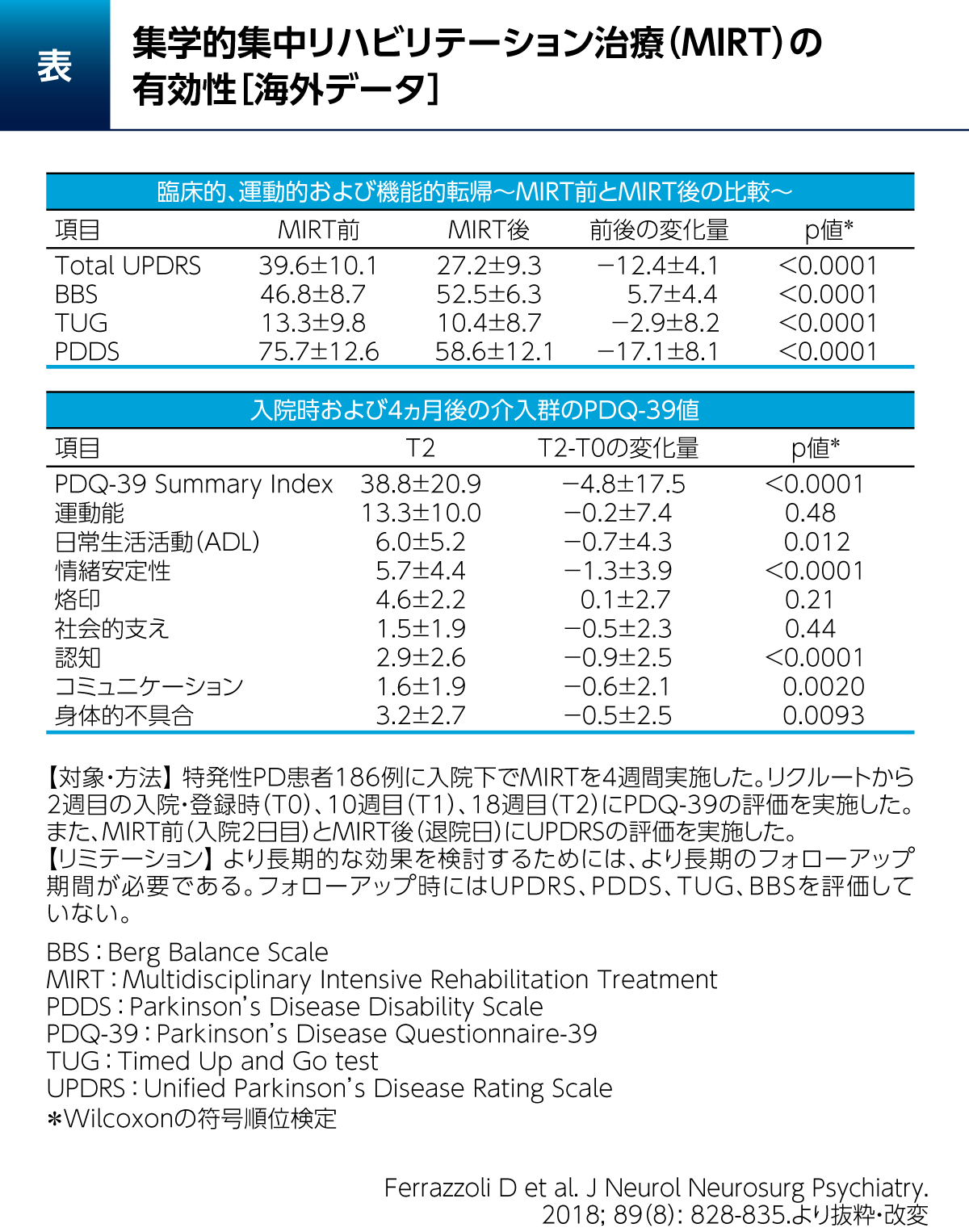
PD患者さん186例に対して1日4時間に及ぶ各種のリハビリテーションと運動を4週間にわたって実施した結果、UPDRSは有意に改善したことが報告されている(表)8)。また、本研究では、この集学的集中リハビリテーション治療(Multidisciplinary Intensive Rehabilitation Treatment:MIRT)の完了から3ヵ月後において、QOLの指標であるPDQ-39 Summary Index、日常生活活動(Activity of dailyliving:ADL)、情緒安定性(Emotionalwell-being)や認知(Cognitions)といった非運動症状関連項目などでも有意な変化が認められた。
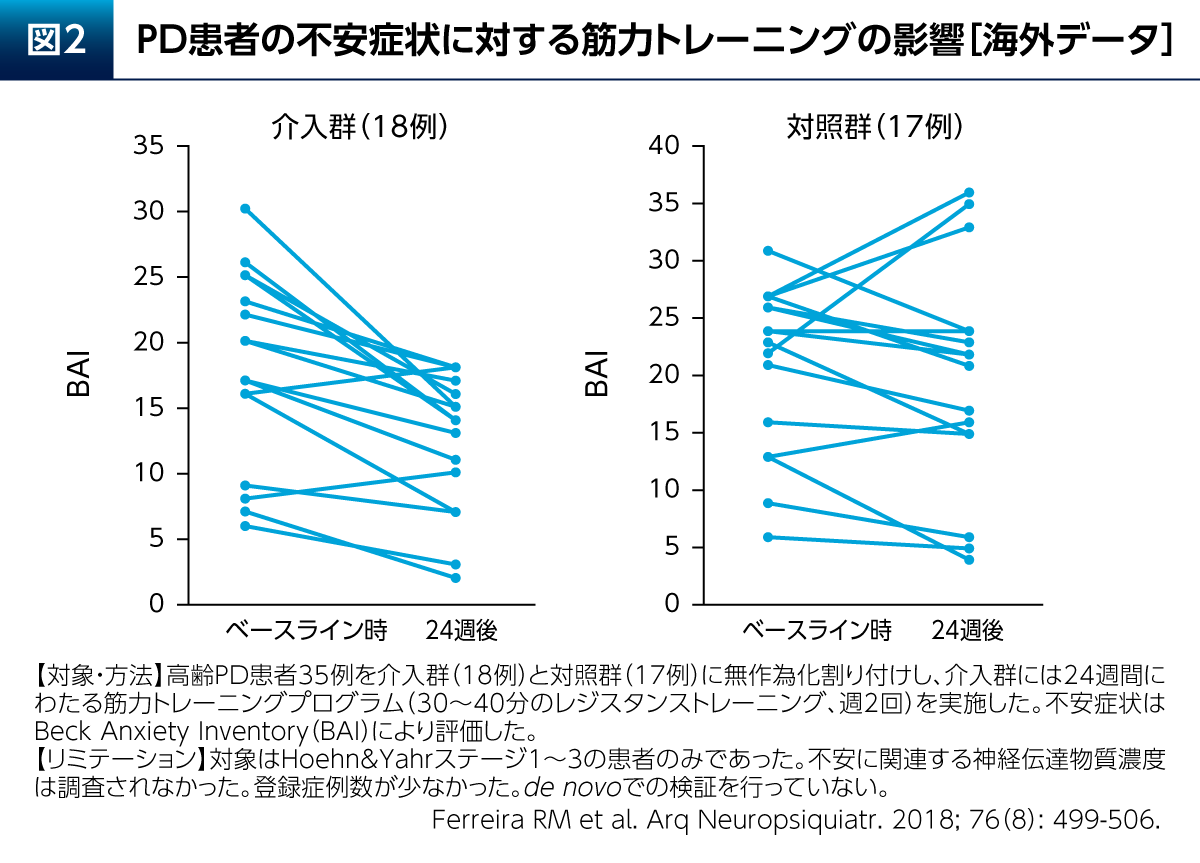
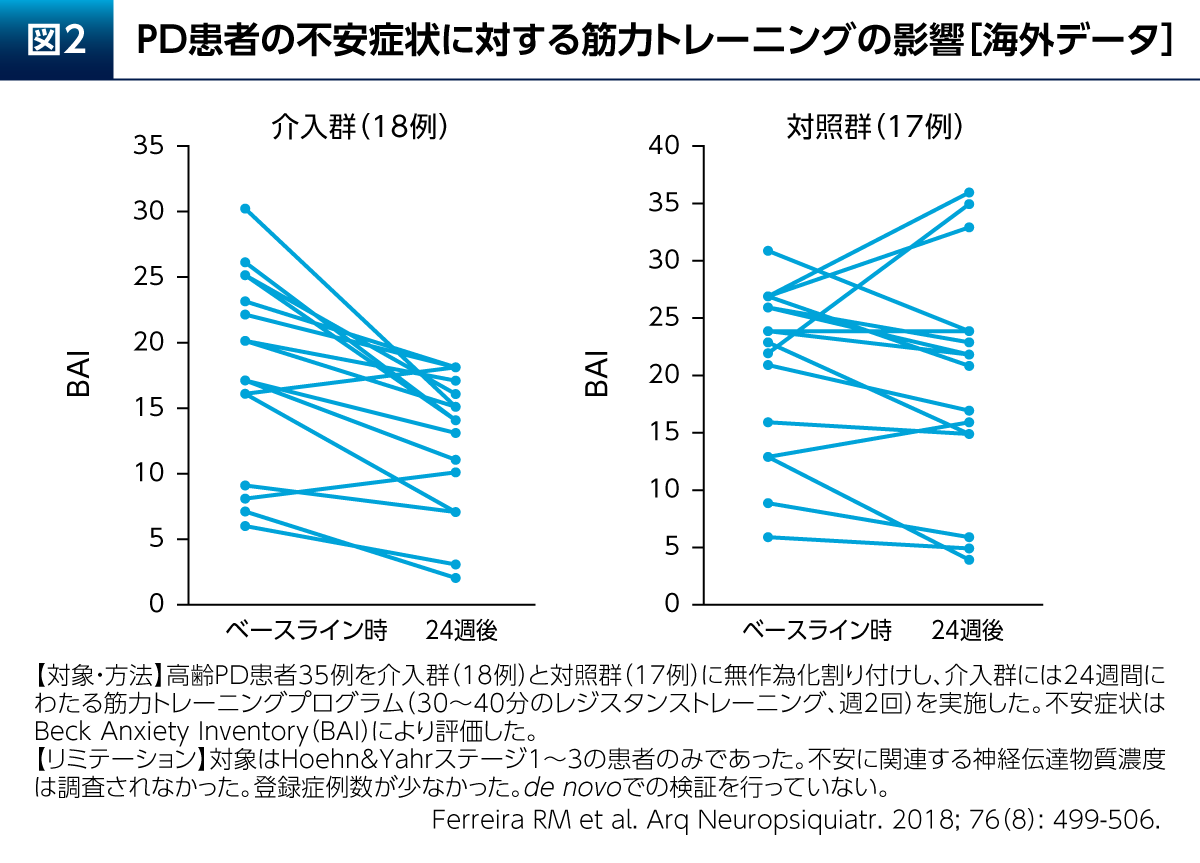
PDにおける非運動症状の1つである不安に対しても、運動療法の影響が示唆されている。高齢PD患者さん18例に24週間の筋力トレーニングプログラムを実施したところ、Beck Anxiety Inventory(BAI)については2例を除き低下した(図2)。また、BAIの平均±SDはベースライン時が18±7.1、24週後は12.2±5.5であった9)。
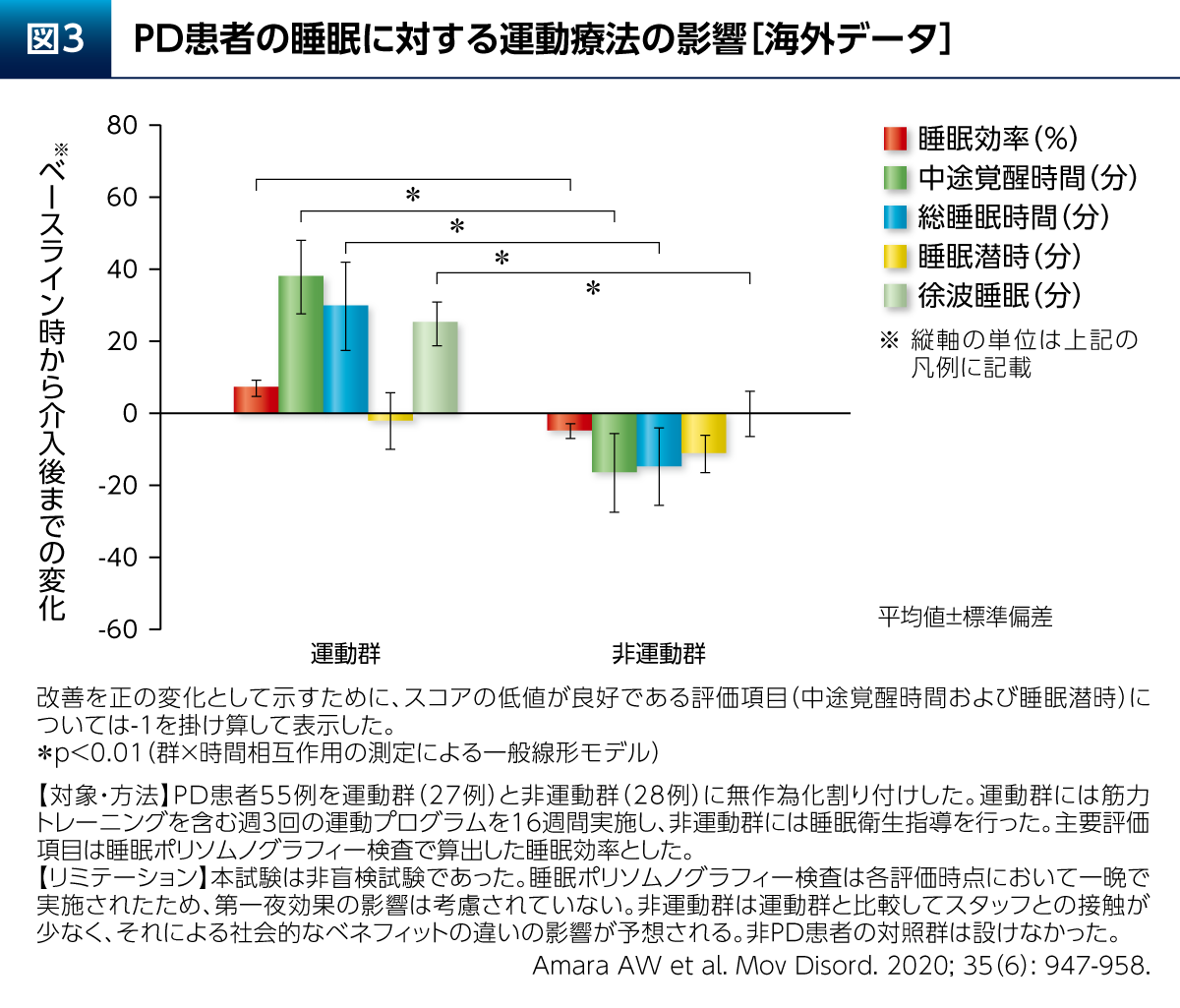
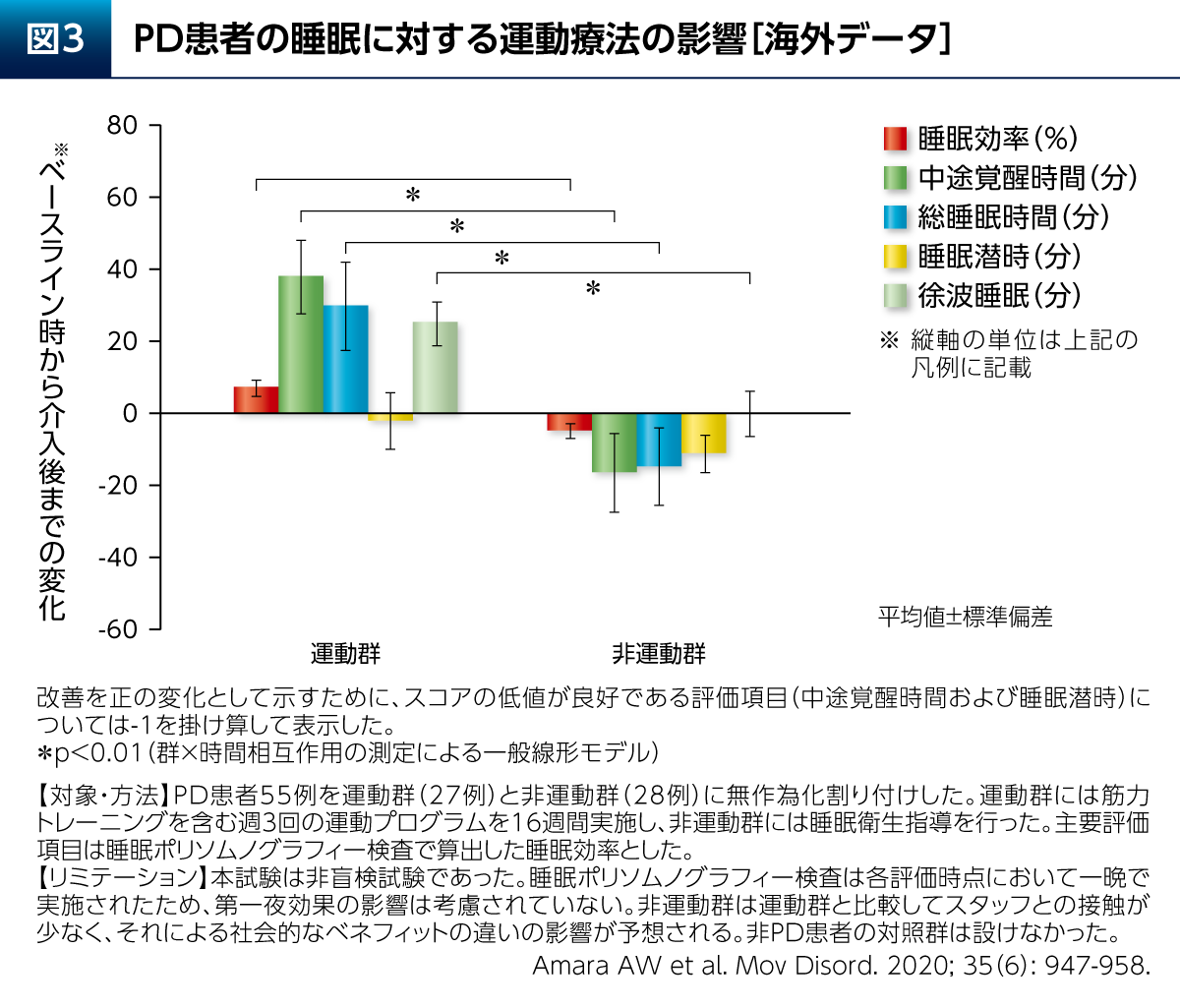
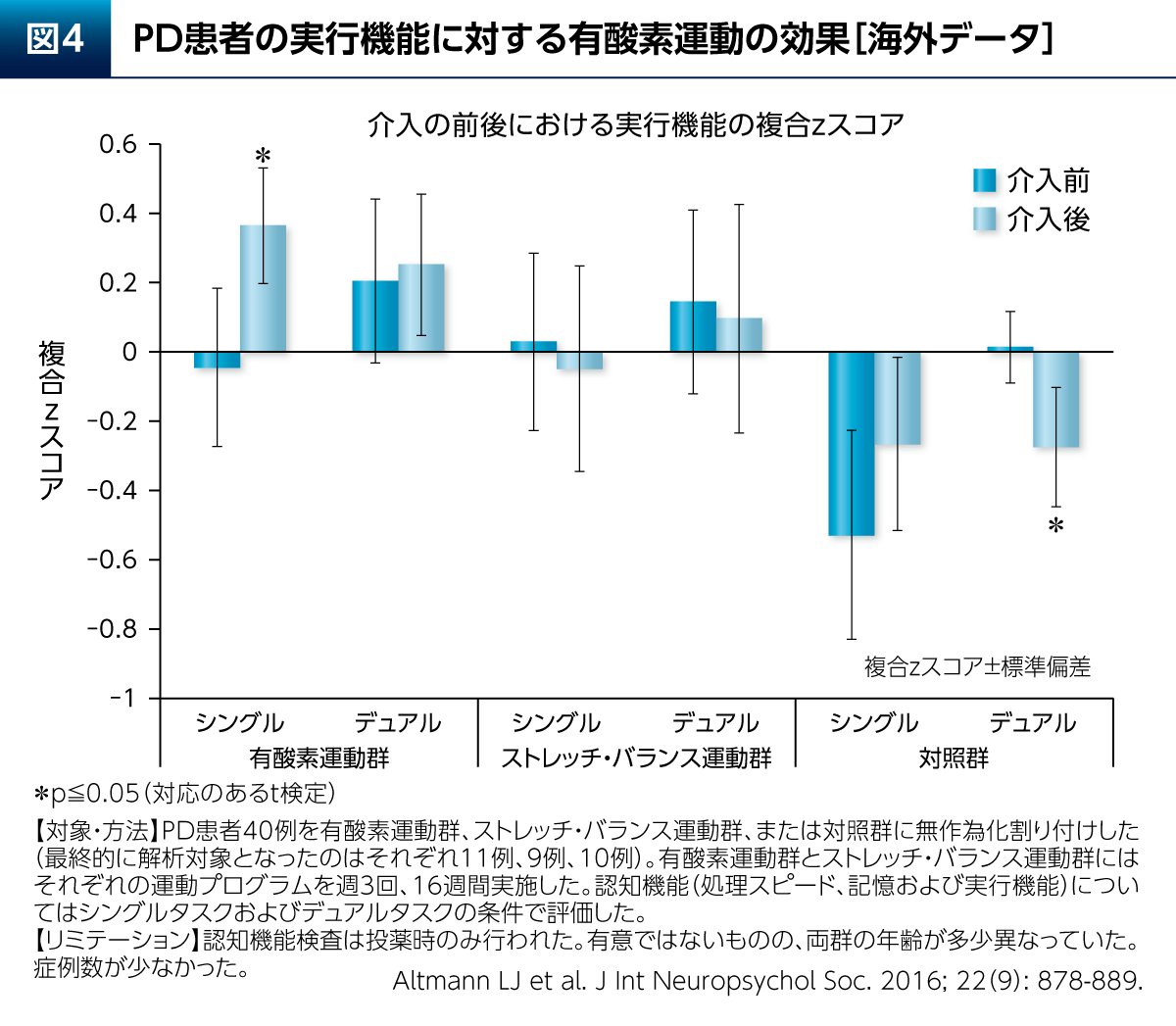
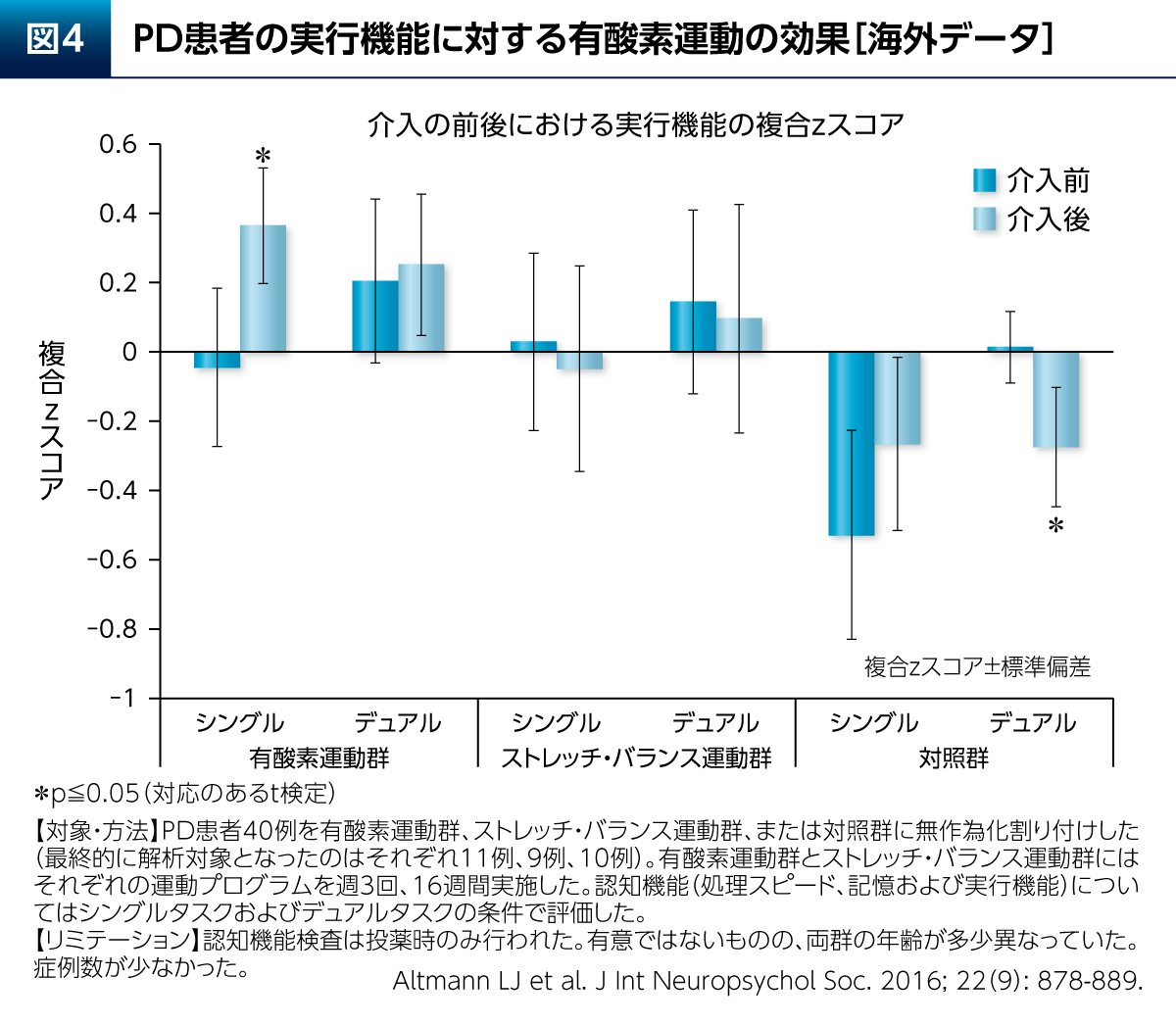
また、PD患者さんの睡眠に対し、運動群(筋力トレーニングを含む)は、睡眠衛生指導のみの群と比較して睡眠効率などを有意に改善したことも報告されている(図3)10)。PDでは熟睡することで翌日のさまざまな症状が改善される「睡眠効果」も考えられ、運動療法による好循環が期待できる。その他、有酸素運動はPD患者さんの認知機能の構成要素の1つである実行機能(シングルタスクの条件下)を改善することも報告されている(図4)11)。
運動・リハビリテーションによる長期的効果
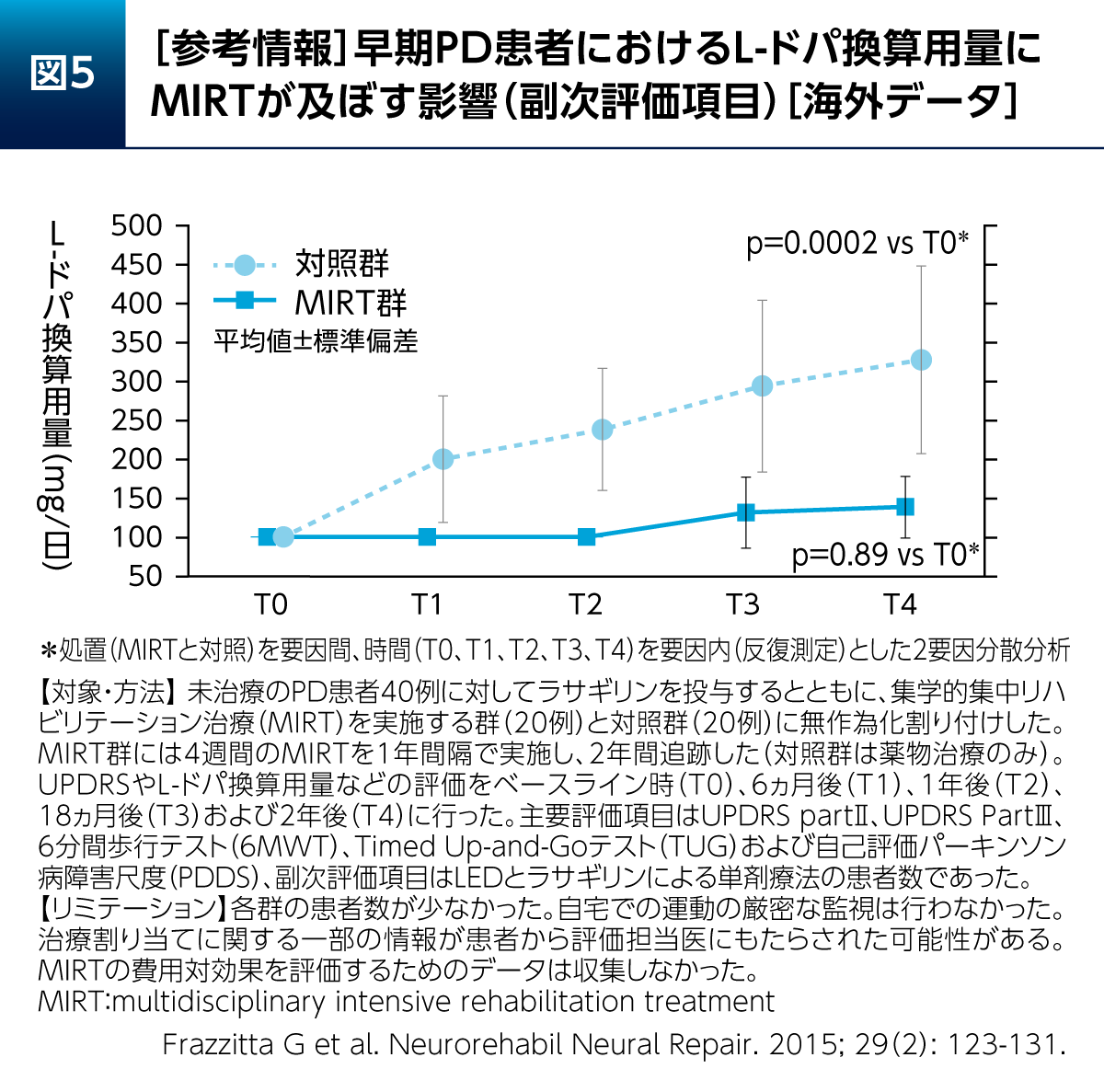
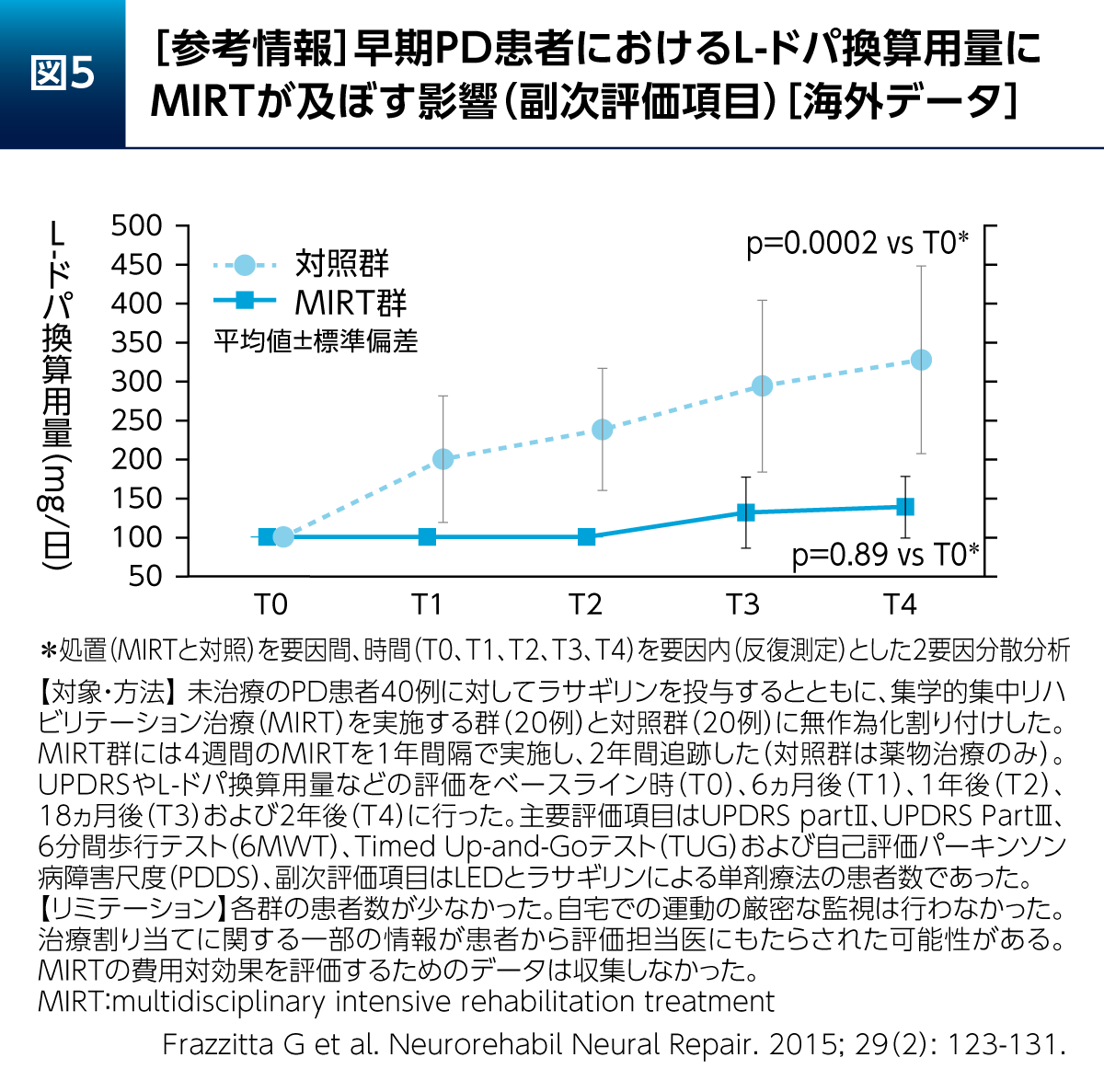
早期からの運動・リハビリテーション開始による、PD患者さんへの長期的な影響についても報告されている。早期PD患者さんに対するMIRTの影響を2年間追跡して検討した研究では、対照群(薬物治療のみ)でL-ドパ換算用量(L-dopa equivalent dosage:LED)が有意に増加したのに対し、MIRTを実施した群ではLEDの有意な増加が認められなかった(図5)12)。
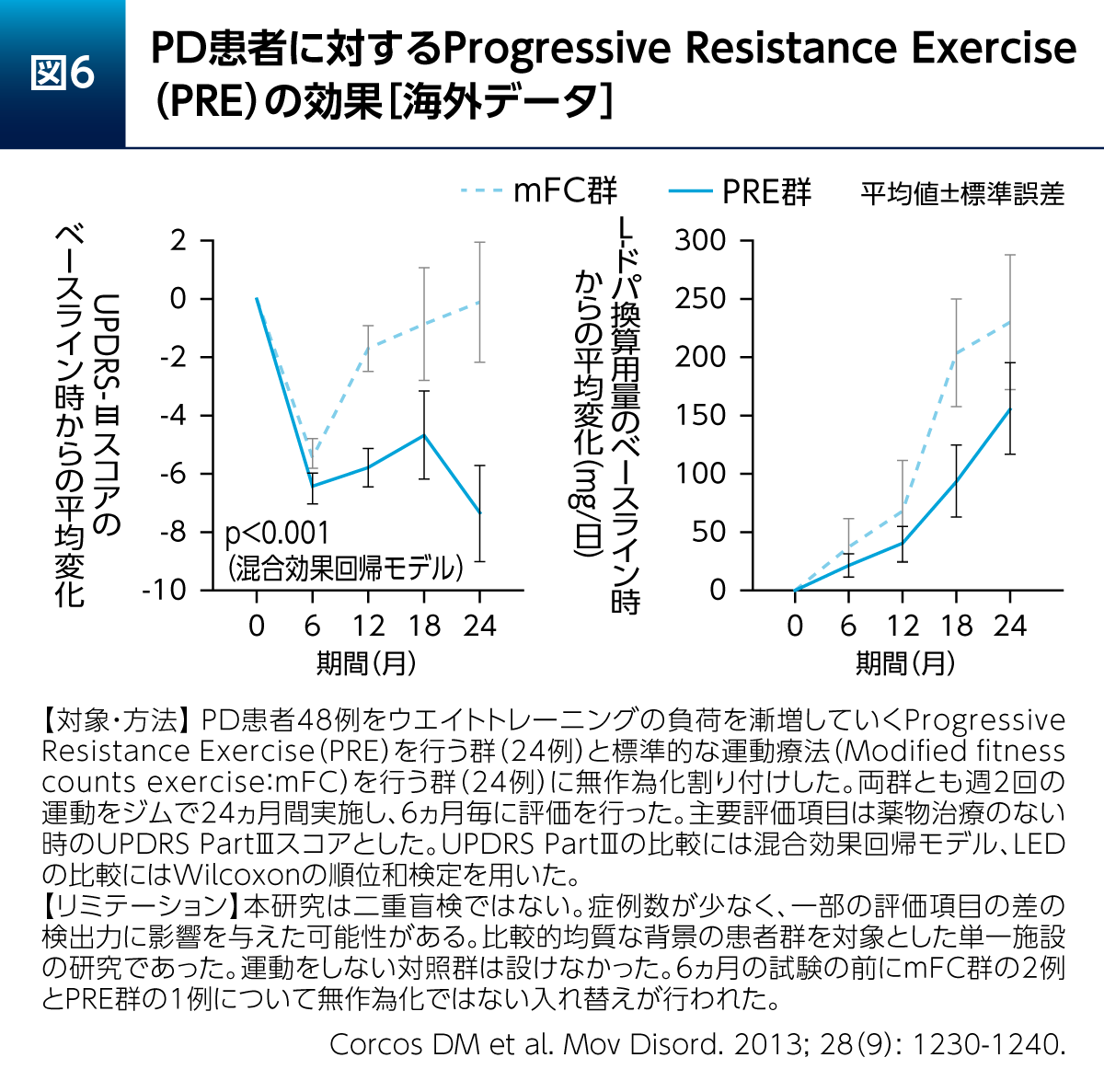
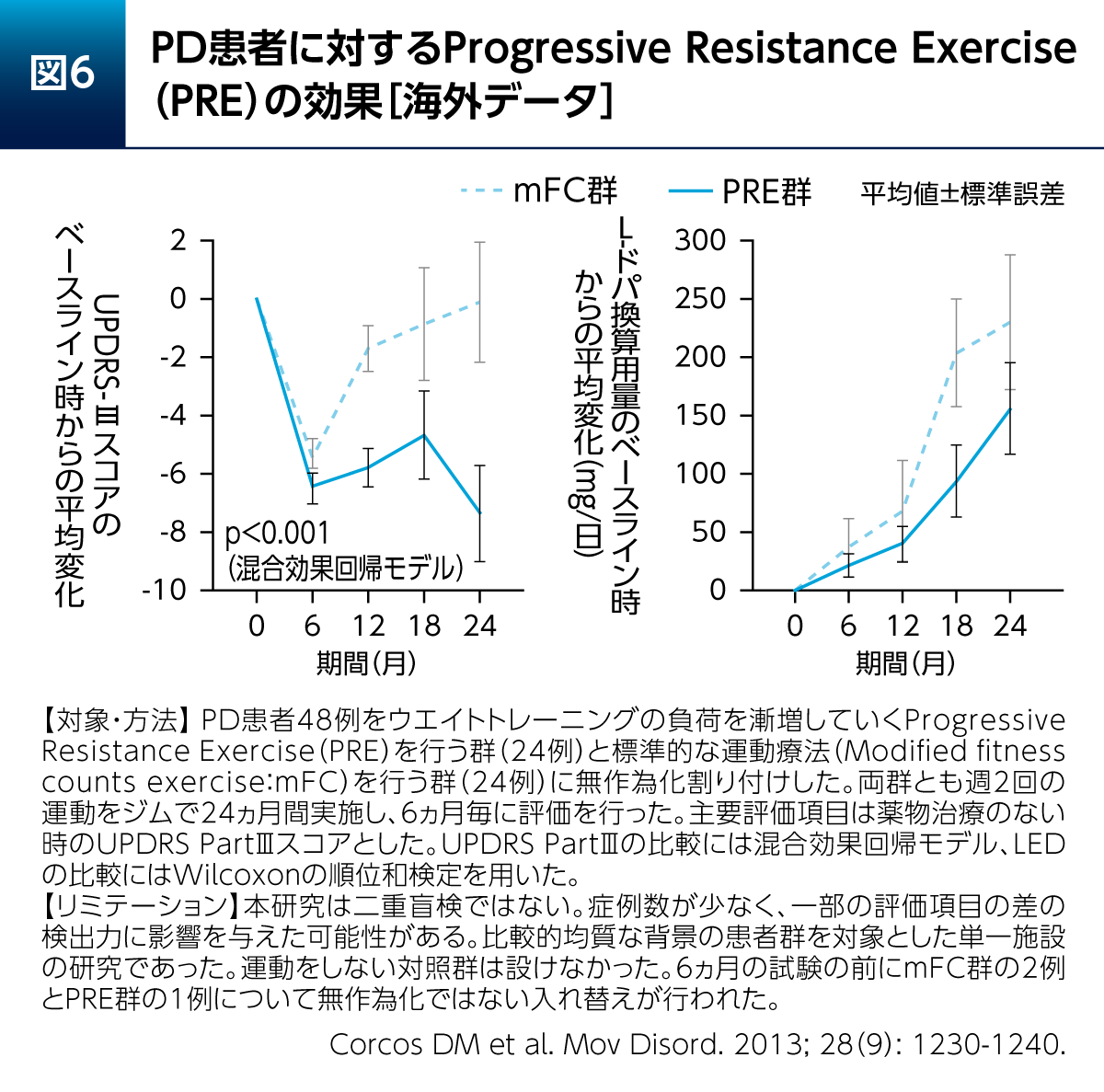
筋力増強を目的としてウエイトトレーニングの負荷を漸増していくProgressive Resistance Exercise(PRE)のPD患者さんへの長期的な影響を検討した研究が報告されている(図6)13)。対照群ではストレッチ、バランス運動および軽度の筋力トレーニングなどを行う標準的な運動療法(Modified fitness counts exercise:mFC)が実施された。
その結果、2年後においてPDの運動症状の指標であるUPDRS PartⅢはPRE群の方がmFC群よりも低下していた(スコア変化の平均差は-7.3、95%CI:-11.3~-3.6、p<0.001:混合効果回帰モデル)。また、LEDの2年後のベースライン時からの平均増加はPRE群で155.8mg/日、mFC群で229.6mg/日であった(平均差は-75.0、95%CI:-200.0~62.0、p=0.29、Wilcoxonの順位和検定)。
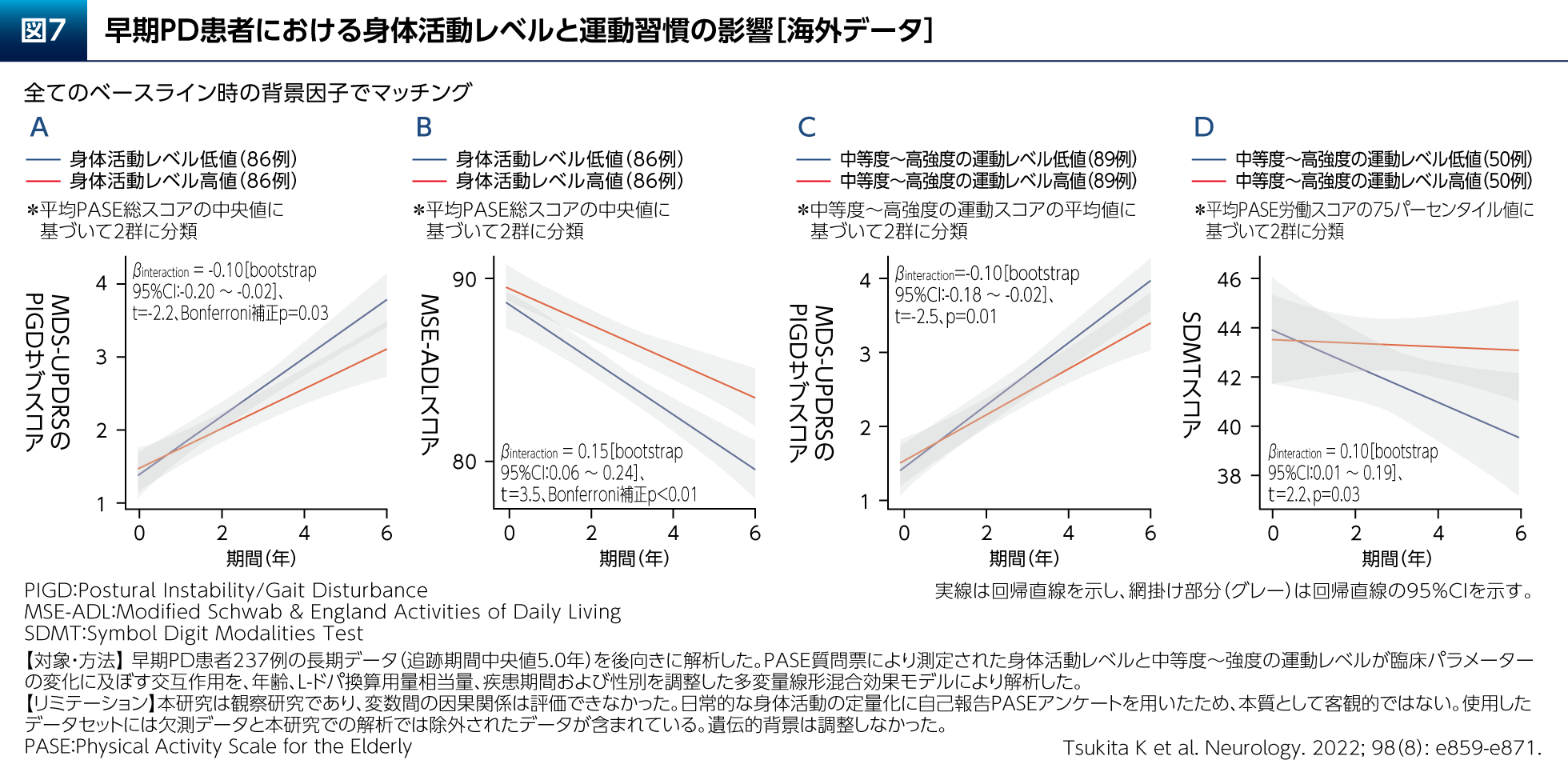
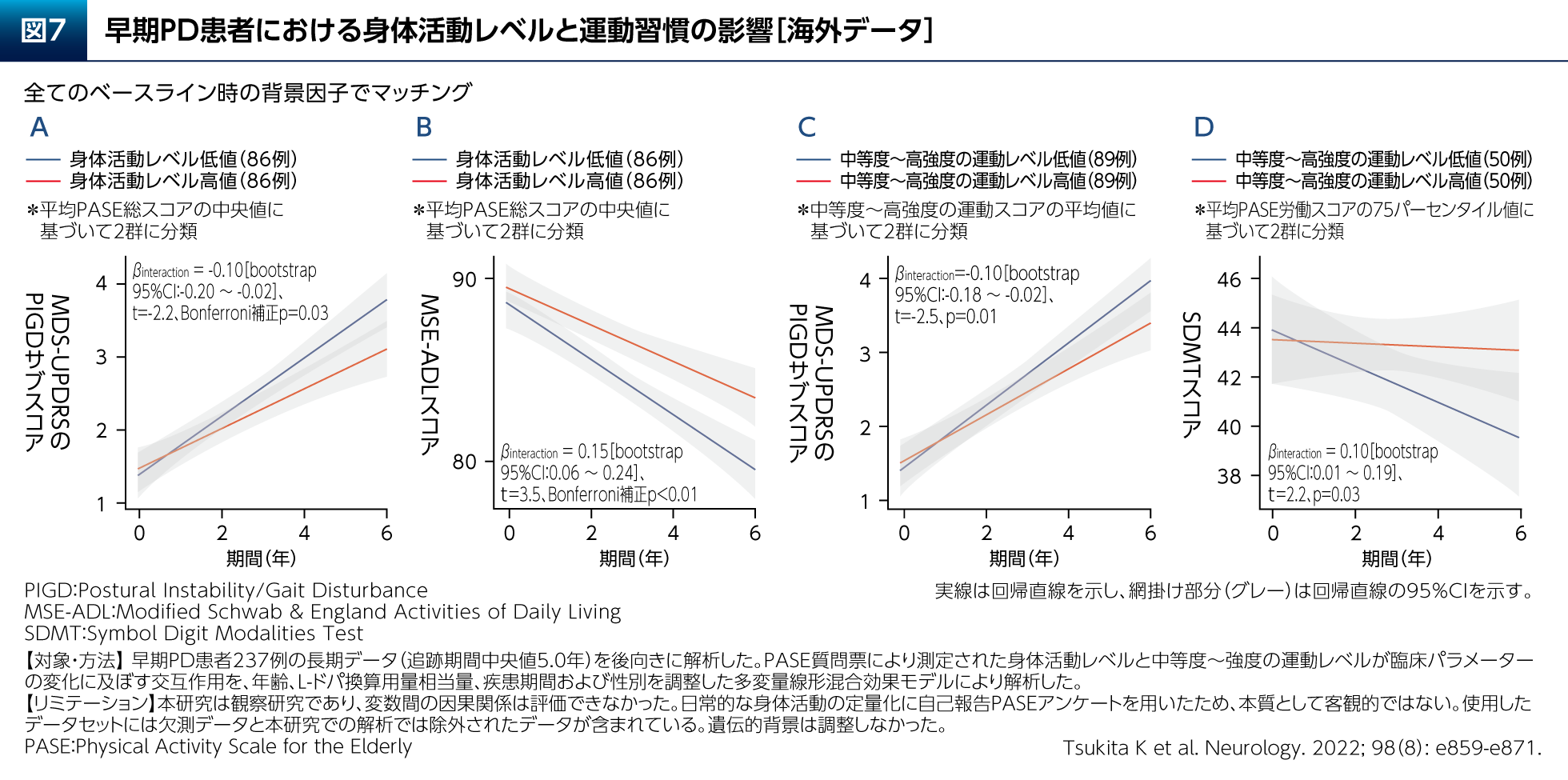
また、早期PD患者さん237例のデータ(追跡期間中央値5.0年)を後向きに解析し、身体活動レベルと運動習慣の影響を検討した研究が報告されている(図7)14)。これによると、傾向スコアによりマッチングした身体活動性が高い群では低い群と比較して、姿勢不安定/歩行障害およびADLが悪化する速度が遅く(図7A、B)、中等度~高強度の運動レベルが高い群では低い群と比較して姿勢不安定/歩行障害が悪化する速度が遅い(図7C)という結果であった。
有効な運動・リハビリテーションを行うには?
外来でPD患者さんに運動・リハビリテーションをお勧めする場合、散歩というよりもウォーキングを行うことを提案している。PDに対するリハビリテーションプログラムとしてLSVT®(Lee Silverman Voice Treatment) BIGの有用性が知られているように、動作を大きくすることが重要である。腕振りと歩幅を大きくすることで全身運動に近いものとなり、筋肉への負荷という点で有効になる。
同じコースを毎日歩いているという患者さんには、時間を計ることを勧めており、30秒でも1分でも時間が縮まったら褒めるようにしている。ゴールを設定してリハビリテーションを行うことが重要である。
前述のように、運動・リハビリテーションを行うことにより薬剤量(LEDとして)の増加を抑えられることがわかっている。よって、運動を頑張ることでお薬を増やさなくてもよくなる可能性をお伝えすることが、患者さんのモチベーション向上につながると考えている。
ただし、過剰な運動によってむしろBDNFの発現が減少する可能性もあり、翌日に疲労が残るようなリハビリテーションはやはり過剰ではないかと考えている。強度を上げていくような運動療法においても、約2~3%ずつゆっくりと強度を上げるプログラムが望ましい。
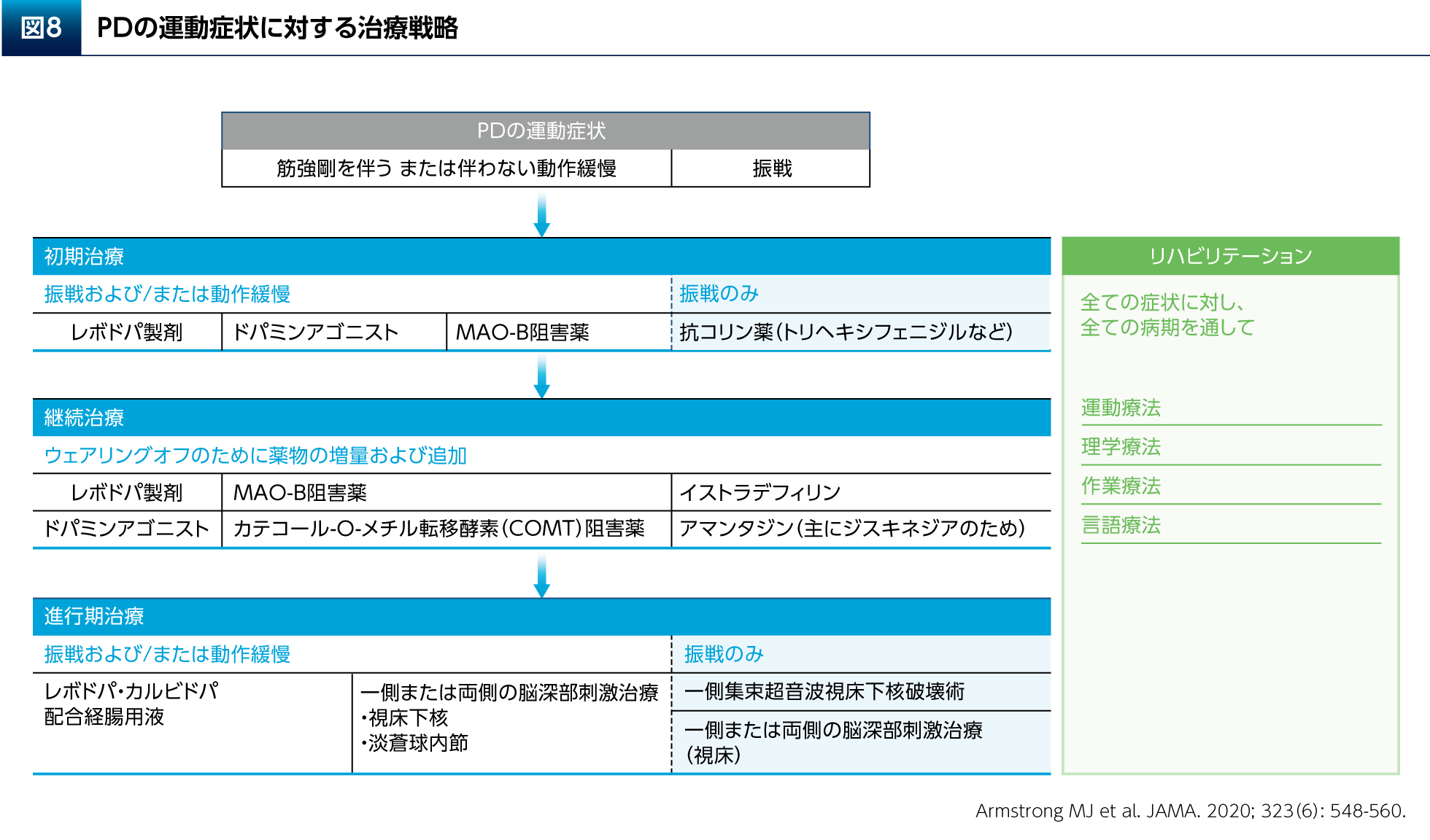
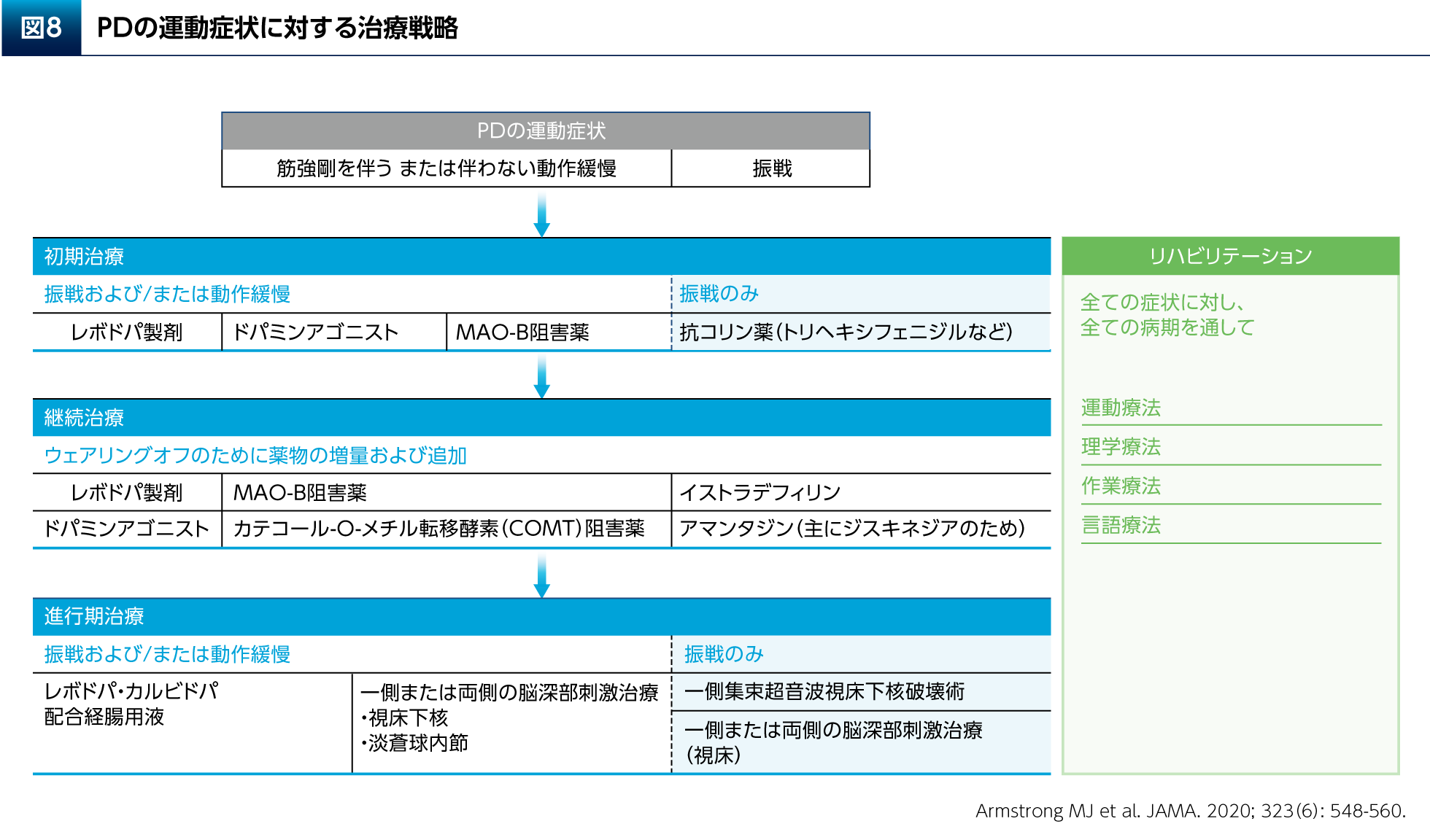
運動・リハビリテーションの開始時期として、PDと診断した時点で患者さんの症状に応じた適切な運動療法の処方が考慮される15)。そして、運動・リハビリテーションは初期から進行期までの全ての病期を通して、薬物治療や手術療法(脳深部刺激療法など)と組み合わせながら継続されるべきと示されている(図8)。
リハビリテーションの継続には、高齢や運動機能低下の影響に加え、痛みや疲労感、うつ症状などの非運動症状などを含めたリハビリテーションの阻害因子の改善を考慮することが必要である16)。
講演2 PD診療におけるEmotional well-beingの重要性 -社会参画との関連性も踏まえて-


PD患者さんのEmotional well-beingとQOL
WHO憲章において健康とは「身体的、精神的、社会的に完全に幸福な状態であり、単に病気や病弱がないだけではない」と定義されている1)。QOLの定義においても身体的、心理的および社会的というキーワードが含まれており2)、これらの3つのキーワードを中心にPD患者さんのEmotional well-being(精神的な健康/幸福、情緒安定性)について考察する。また、職業的な要因など、社会参画との関連性についても取りあげる。
Emotional well-beingが重要であるのは、それがQOLと密接に結びついているからである。自立や社会参画がEmotional well-beingにつながり、身体的および物質的に満たされることと相まってWell-being(健康/幸福)が得られる(図1左)3)。また、QOLを充実させるには、身体的、精神的および社会的健康の3つの柱が重要である(図1右)4)。


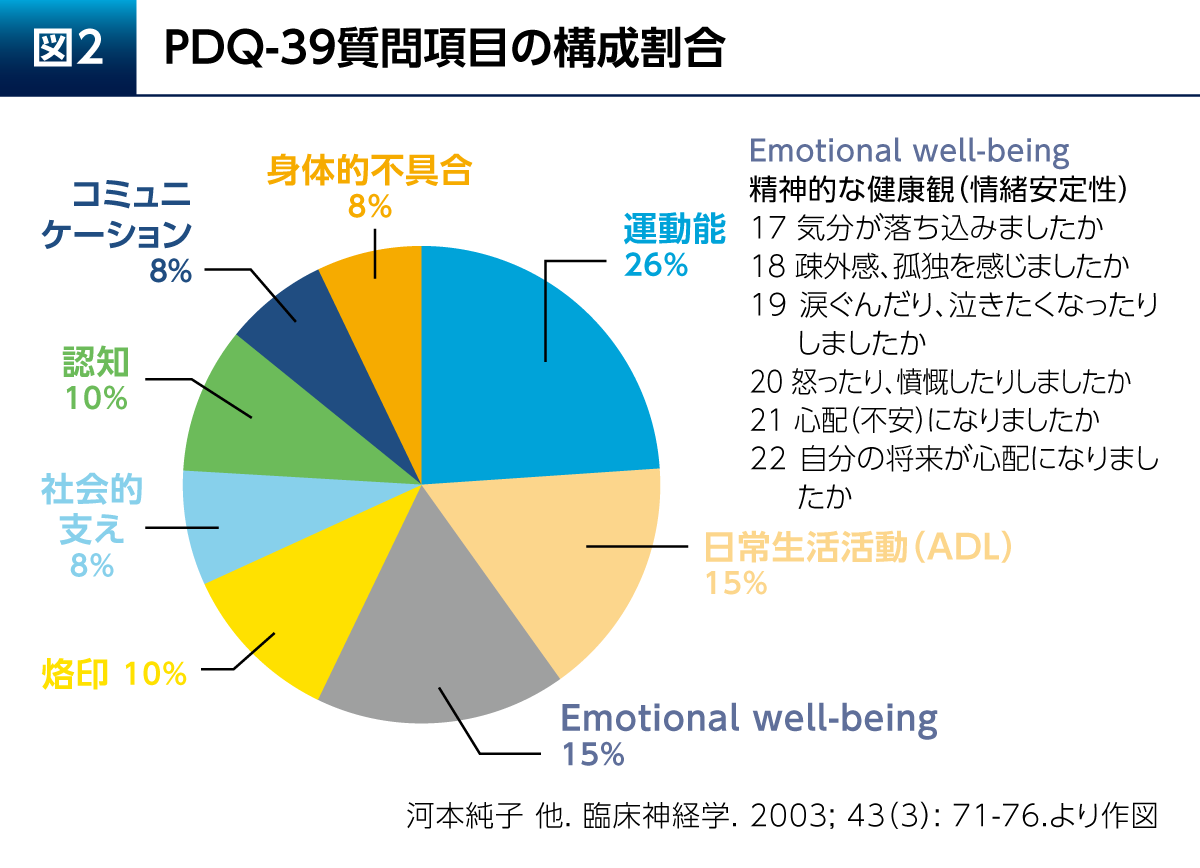
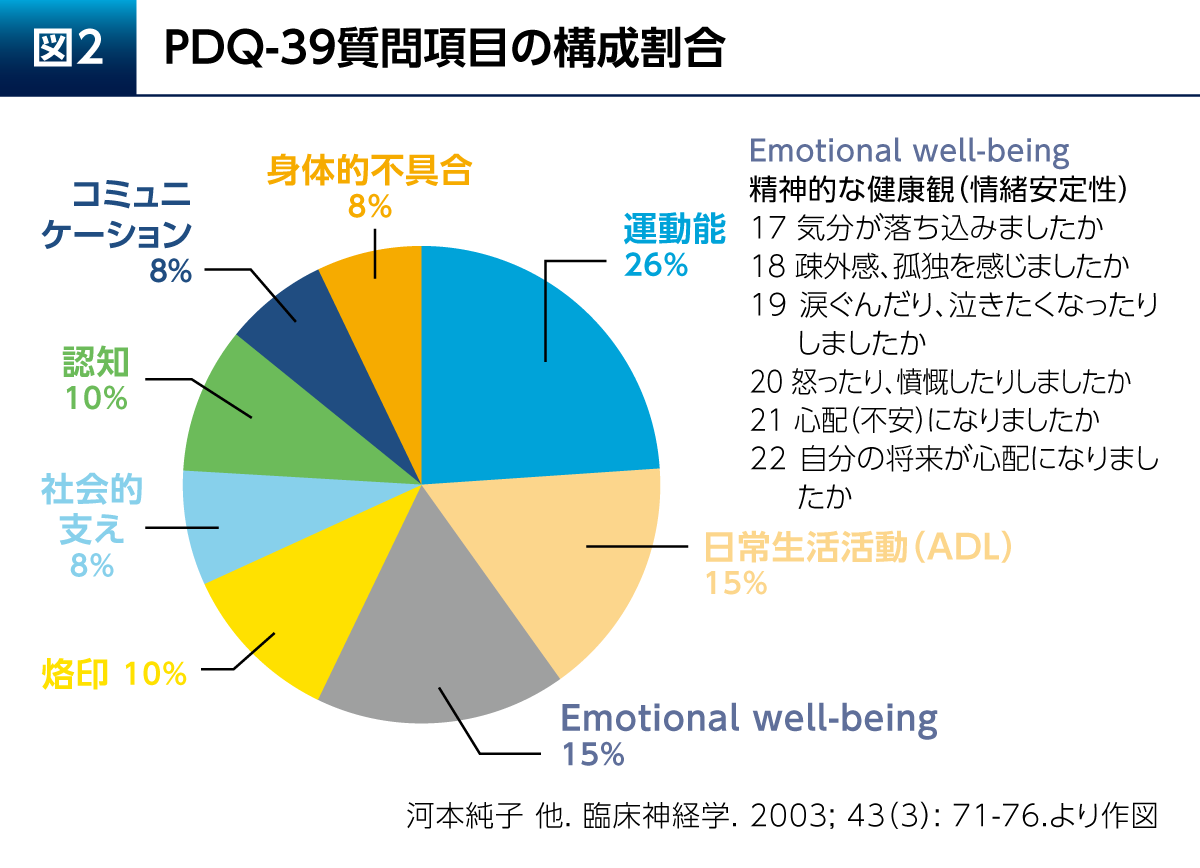
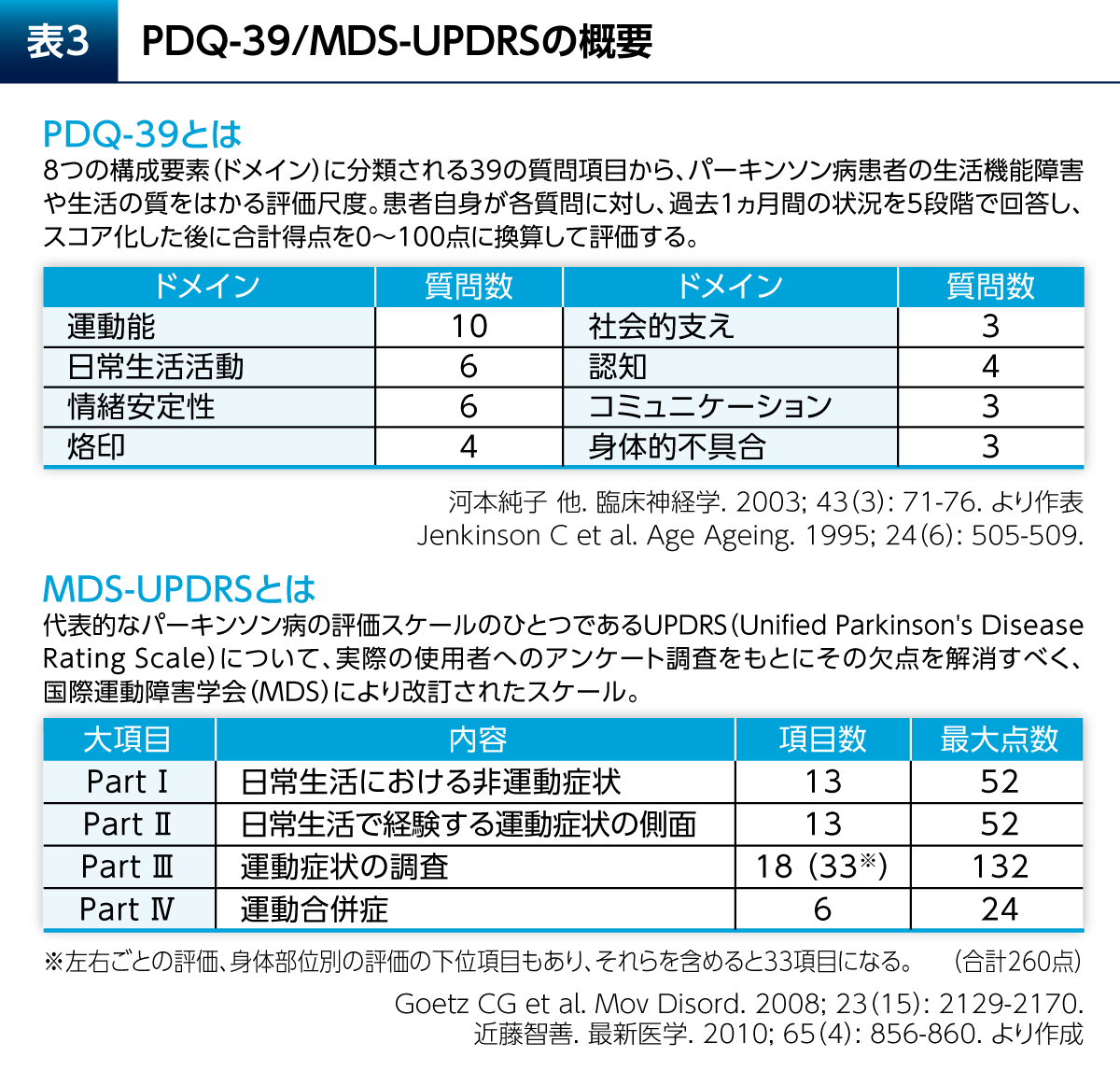
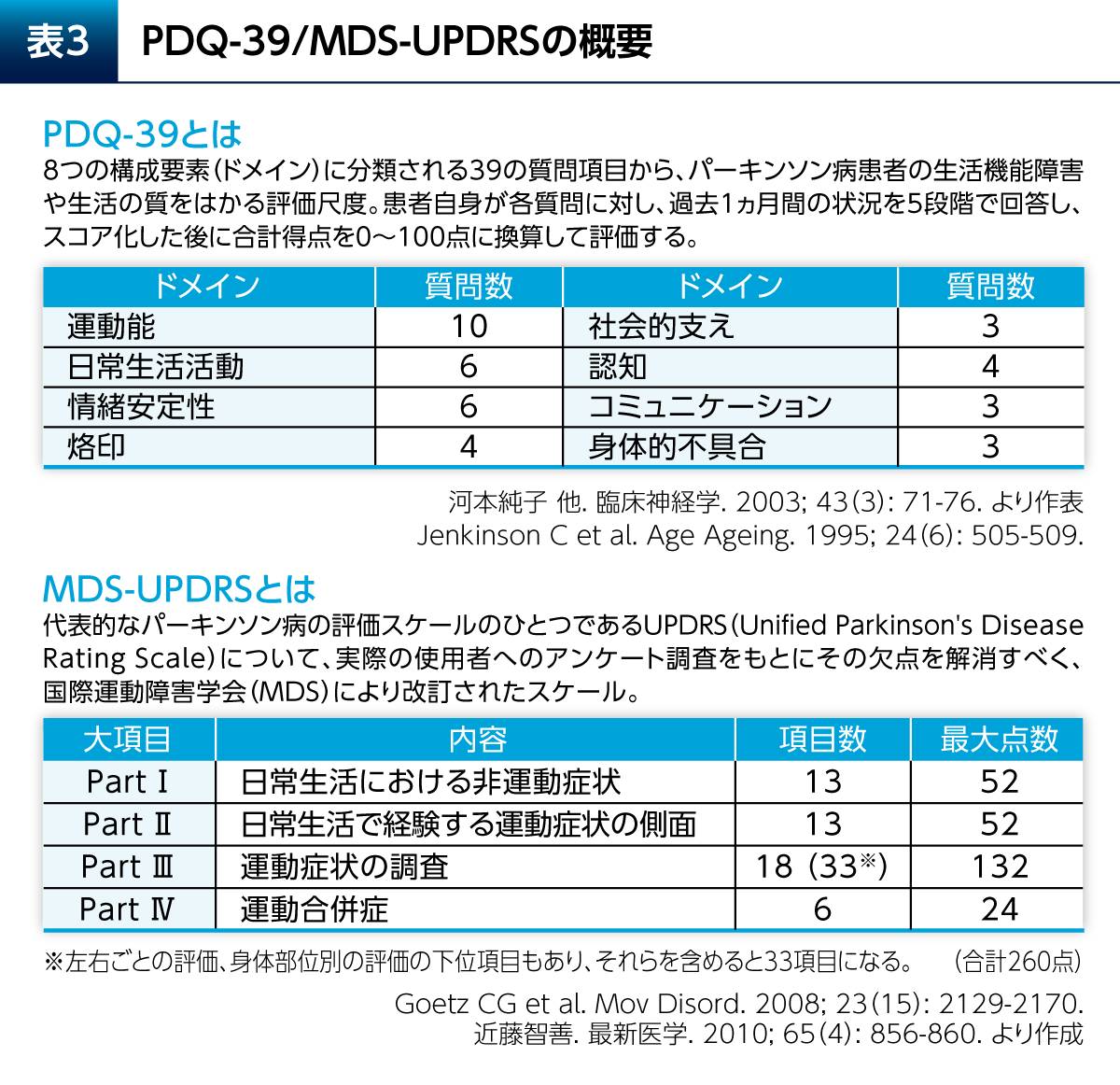
健康関連QOLは、患者さん自らが報告するPatient Reported Outcome(PRO)として評価される。Parkinson’s Disease Questionnaire(PDQ)-39はPD患者さんの健康関連QOLの評価に最もよく使用される評価尺度であり、運動能、日常生活活動(ADL)、烙印などの8つの構成要素(ドメイン)に分類される39の質問項目で構成される(図2)5)。構成要素の1つであるEmotional well-beingは、PDQ-39全体の質問項目数の15%を占めている。Emotional well-beingには、気分、疎外感/孤独、涙ぐむこと、怒り、不安および将来への心配についての6つの質問が含まれ、精神的な要素の強いものであることがわかる。
Emotional well-beingに影響する因子
PD患者さんのEmotional well-beingに影響する因子について、いくつかの研究により検討されている。その1つでは、幻覚、精神障害、流涎およびジスキネジアがPDQ-39のドメインのうちのEmotional well-beingに有意に関連していることが示された(相関係数はそれぞれ0.52、0.58および0.50、いずれもp<0.05:Spearmanの順位相関係数)6)。この結果について臨床医として考えると、PD患者さんが精神的に困っているのは前述のような症状を他人に見られたときの負い目のようなものであると推察される。また、うつ症状や特性不安といった気分障害がPDQ-39のEmotional well-beingに独立して関連するという報告があり(うつ症状:<0.001、特性不安:<0.001、階層的回帰分析)7)、気分障害に対する配慮も重要である。さらに、うつ症状や不安だけでなく、Hoehn & Yahr重症度分類もまたEmotional well-beingへの関連が報告されており(うつ症状:p≦0.001、不安:p≦0.001、Hoehn & Yahr重症度:p≦0.05、うつ症状・不安で調整した多変量線形回帰分析)8)、PDの運動症状についても考慮が必要である。
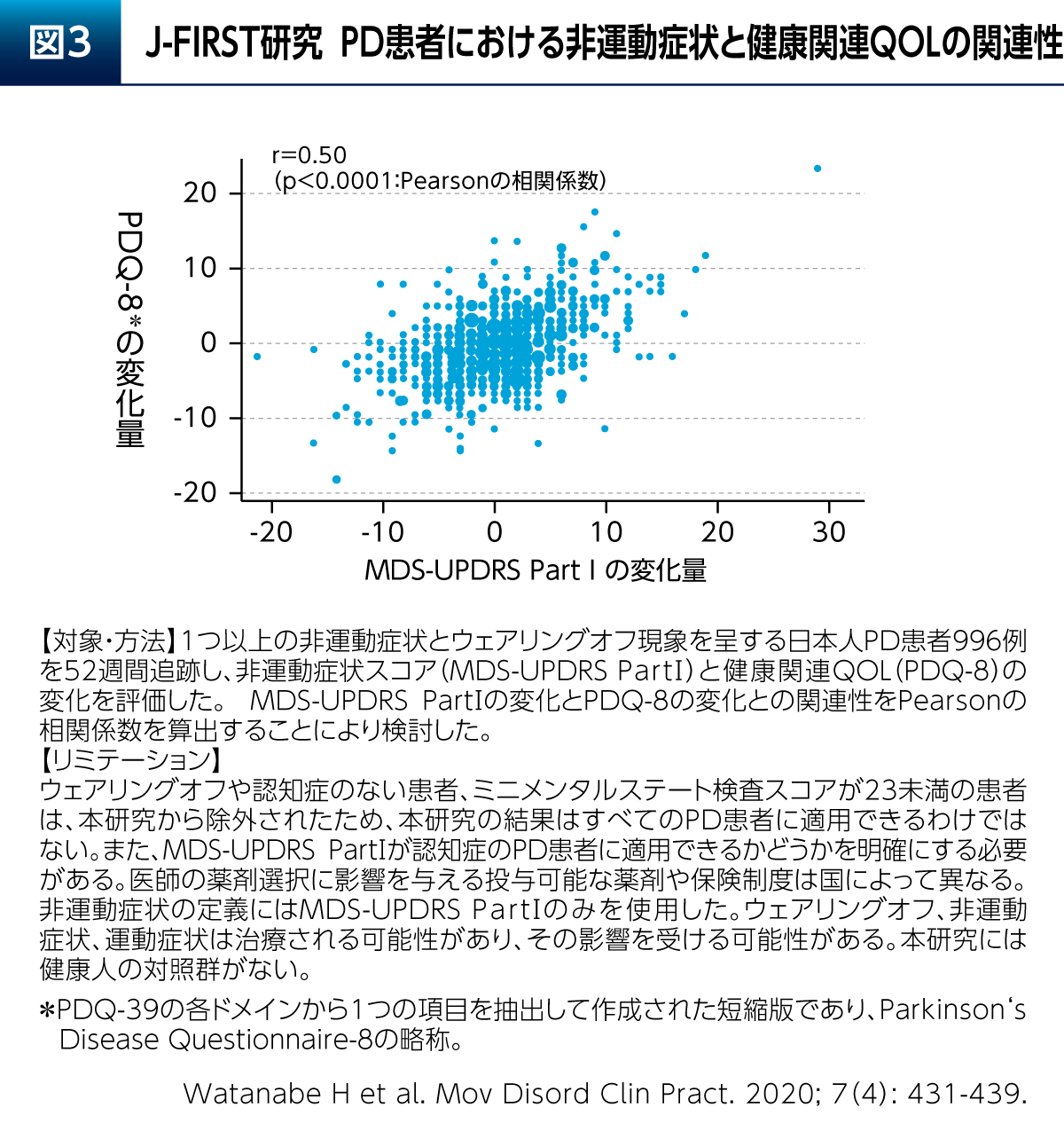
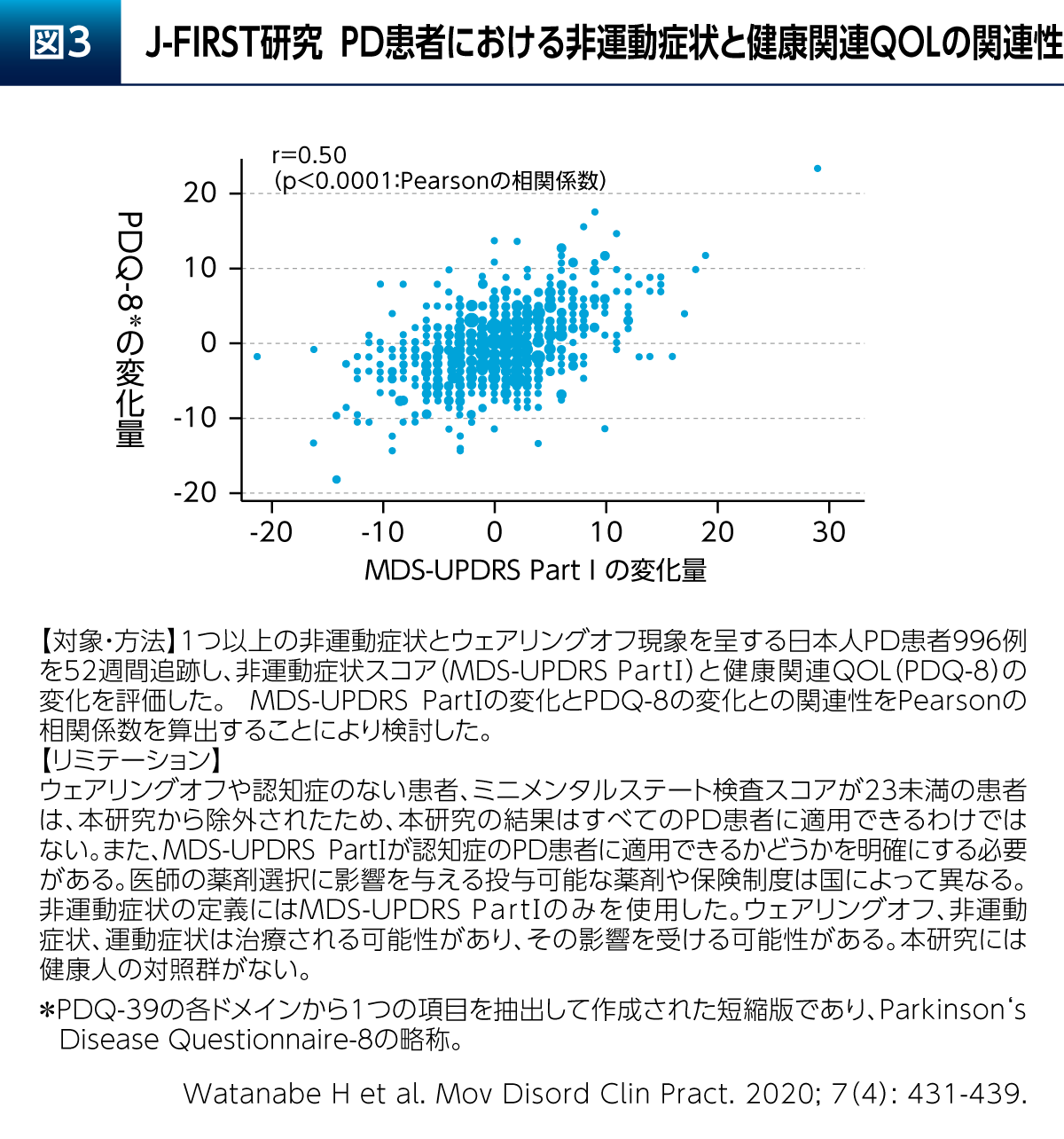
日本人PD患者さん996例を対象として非運動症状と健康関連QOLの変化を評価した観察研究であるJ-FIRST研究からは、MDS-UPDRSのPart Ⅰ(非運動症状)の変化がPDQ-39の短縮版であるPDQ-8の変化と有意に関連していることが報告されている(図3)9)。よって、Emotional well-beingを考慮したPD患者さんの治療においては非運動症状への配慮が求められる。
PD患者さんでは社会的役割の喪失が大きな問題となる
社会参画はPD患者さんのEmotional well-beingに重要である。PD患者さんが職を失うことは社会的孤立に繋がると考えられる。13の研究の系統的文献レビュー10)によると、PD患者さんは一般集団よりも4~7年早く退職していることが報告されている。また、この研究では23~75%の患者さんがPDのために早期退職しており、労働能力を最も低下させる症状は運動緩慢と疲労であること、PD患者さんの早期退職は高い社会的コストと個人の生涯年収の大きな損失と関連していることも示されている。その他、就労しているPD患者さんの多くは職場の調整を求めているが、雇用主は必ずしもそれをサポートしていないことも報告されており、これらの問題を今後、解決していく必要がある。
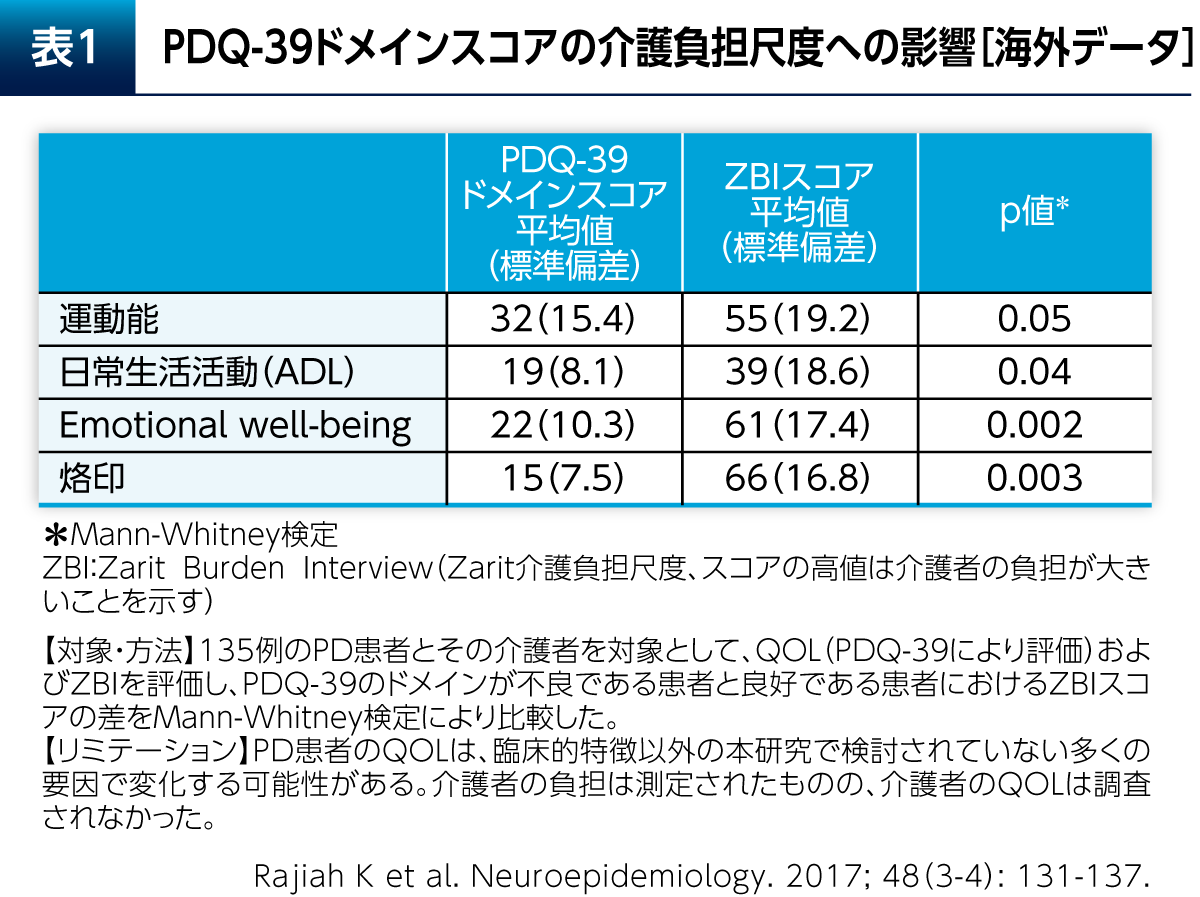
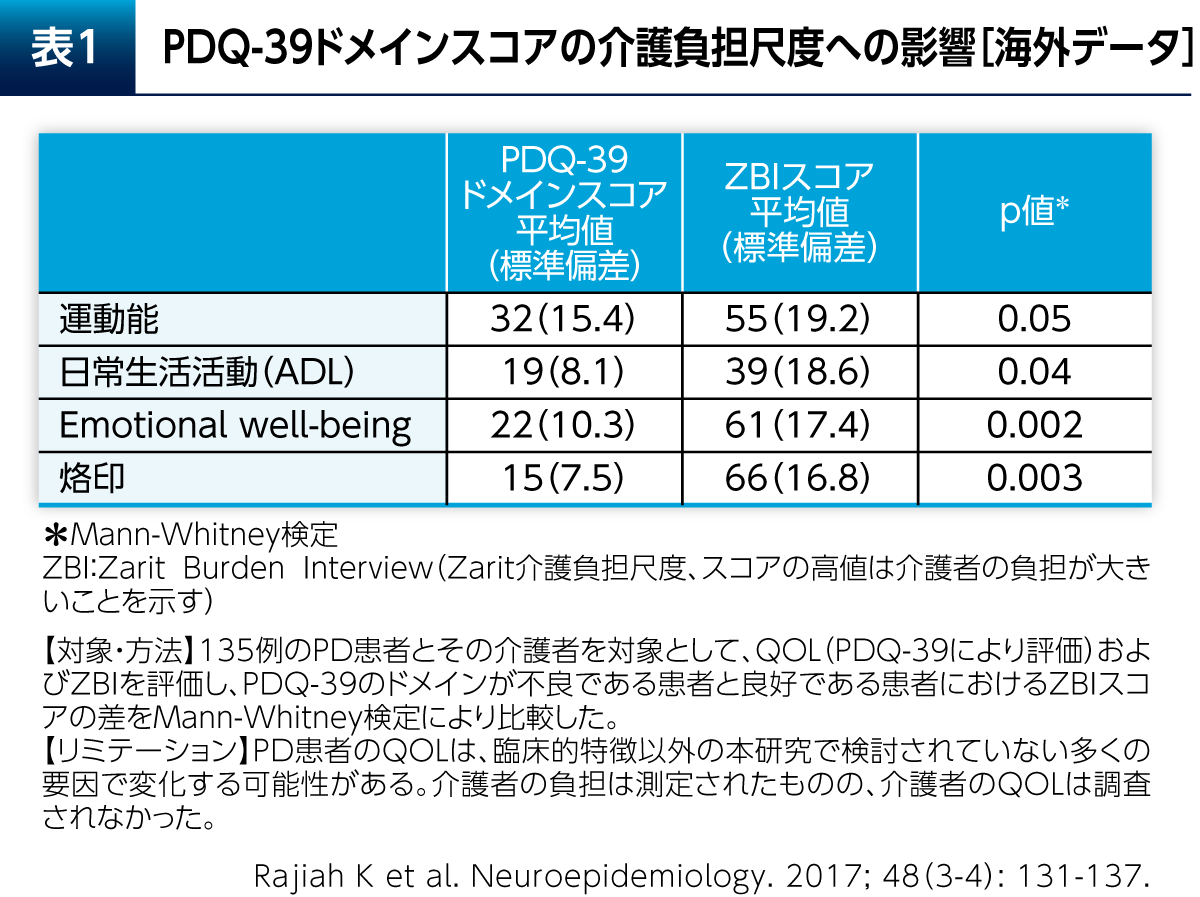
Emotional well-beingは介護負担にも大きく影響する。運動能やADLだけでなくEmotional well-beingや烙印が介護負担度に関連していることを示唆するデータが報告されている(表1)6)。よって、Emotional well-beingを向上させることは、配偶者や家族との関係を良いものにしていく上で重要である。
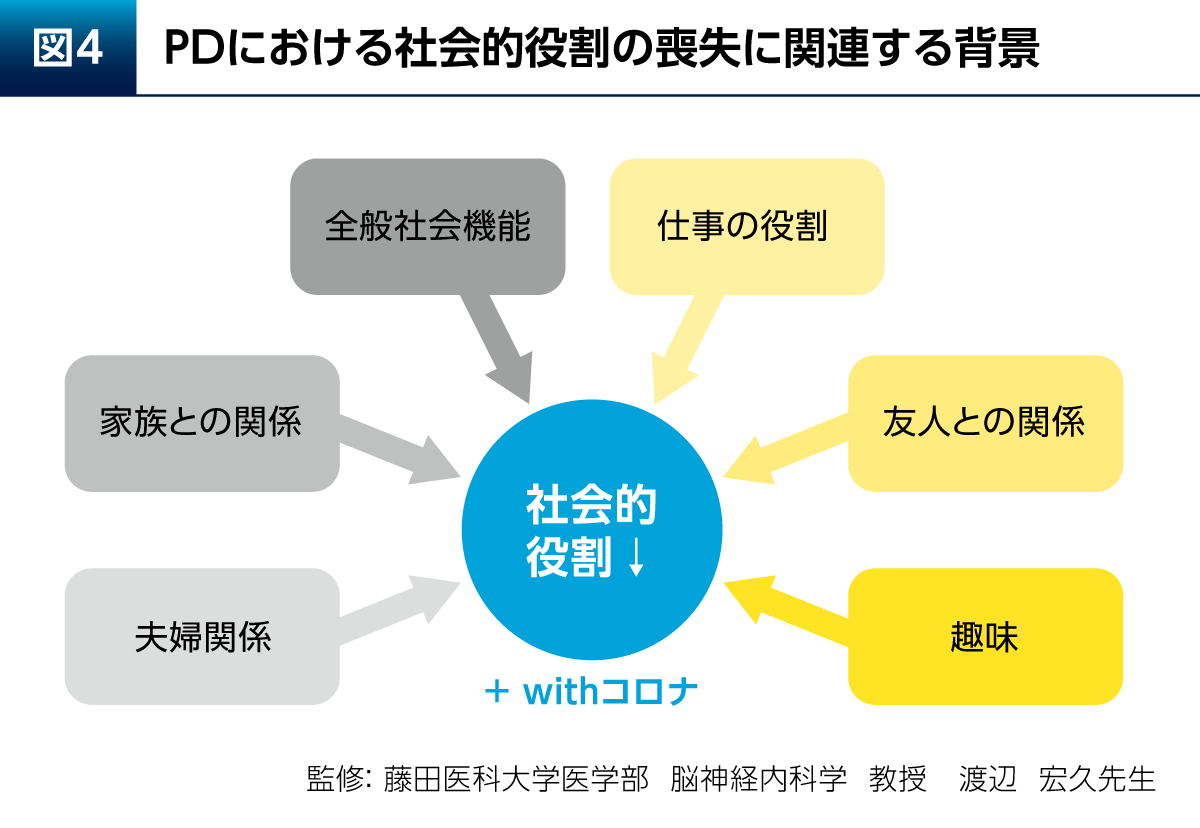
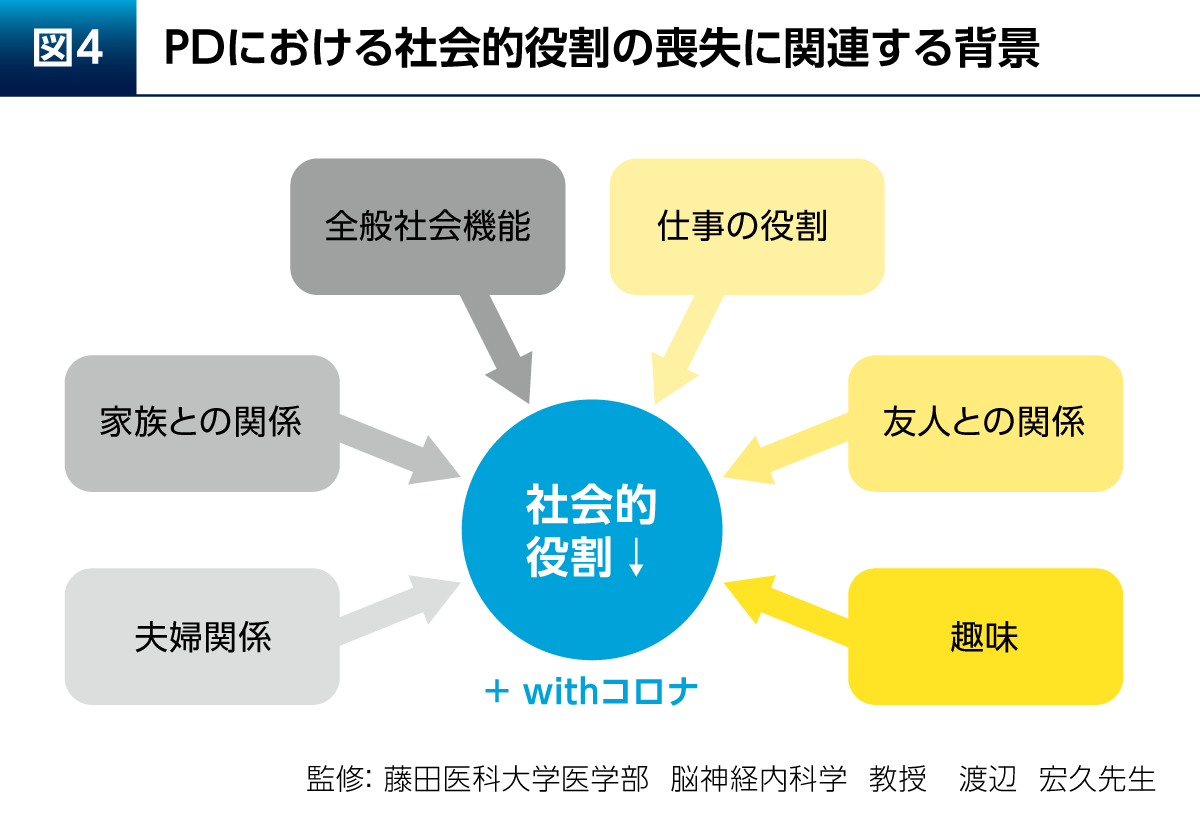
PDにおける社会的役割の喪失には、全般社会機能や仕事の役割が失われること、家族との関係や夫婦関係、友人との関係、趣味を楽しむことが上手くいかなくなるといった問題が関連している(図4)。そして、現在はwithコロナも重なっているため、われわれが想像する以上にPD患者さんのEmotional well-beingは以前よりも低下している可能性がある。
私は“働く”という言葉には「端(はた)を楽(らく)にする」という意味も込められているのではないかと考えている。周りを楽にするということであれば、何歳になっても“働く”ことができる。高齢のPD患者さんは社会的役割を喪失しやすいが、「今の状態で周りの方々をどのように楽にすることができるか、考えてみませんか」と伝えている。また、家事を頑張っている患者さんについては、家事の大変さや大切さをご家族にあらためて共有するなど、さまざまなアプローチを試みている。
PD患者さんは会社から解雇されたり、退職を余儀なくされたりすることが多い。産業医が在籍する企業であれば、まずは主治医と産業医が密に連携することが就労を維持する第一歩になると考えている。そのような連携の中で、患者さんが周囲にPDであることを告知したり、在宅勤務にしたりすることで就労を維持できた事例も経験している。
Emotional well-beingを考慮した治療選択
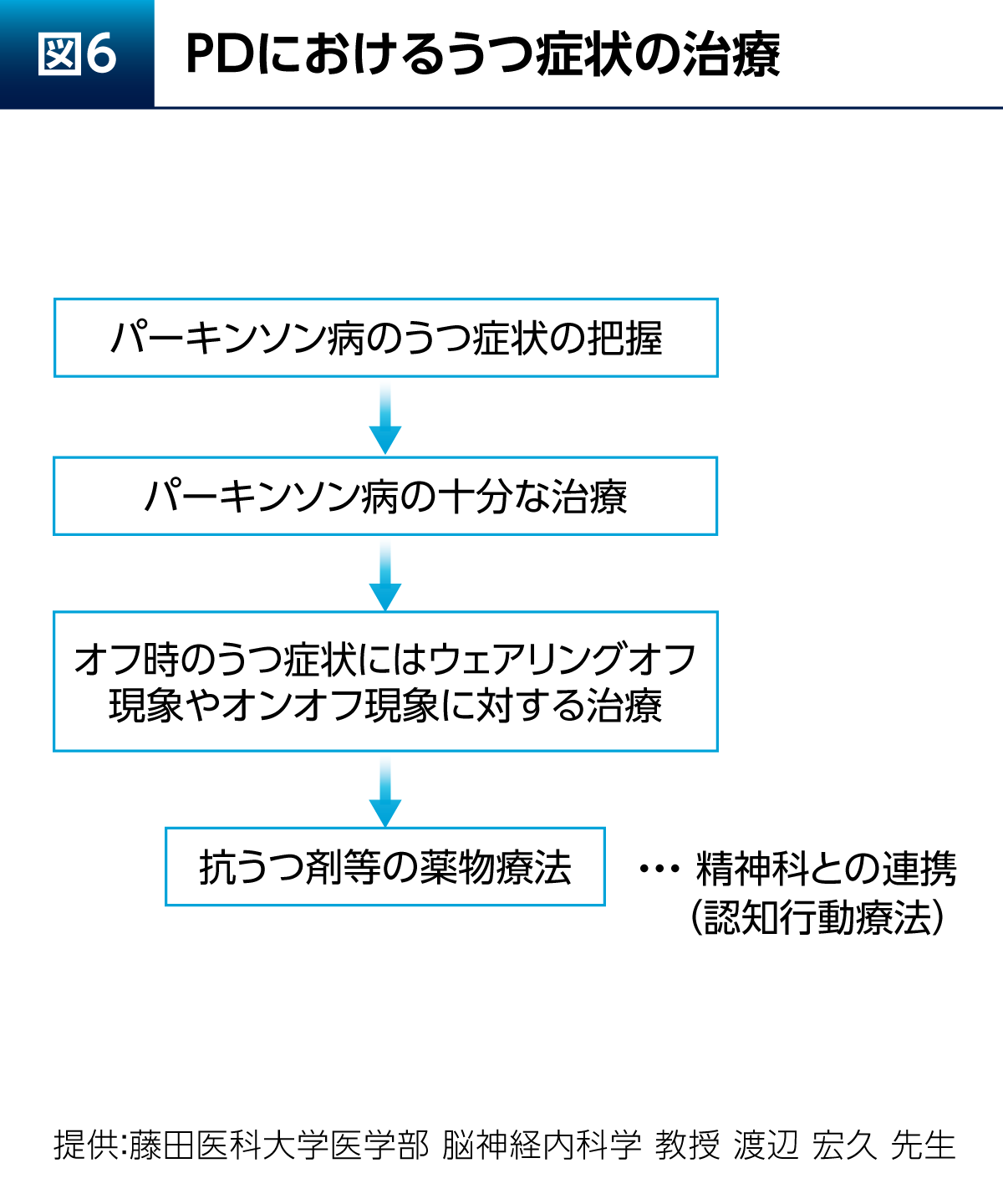
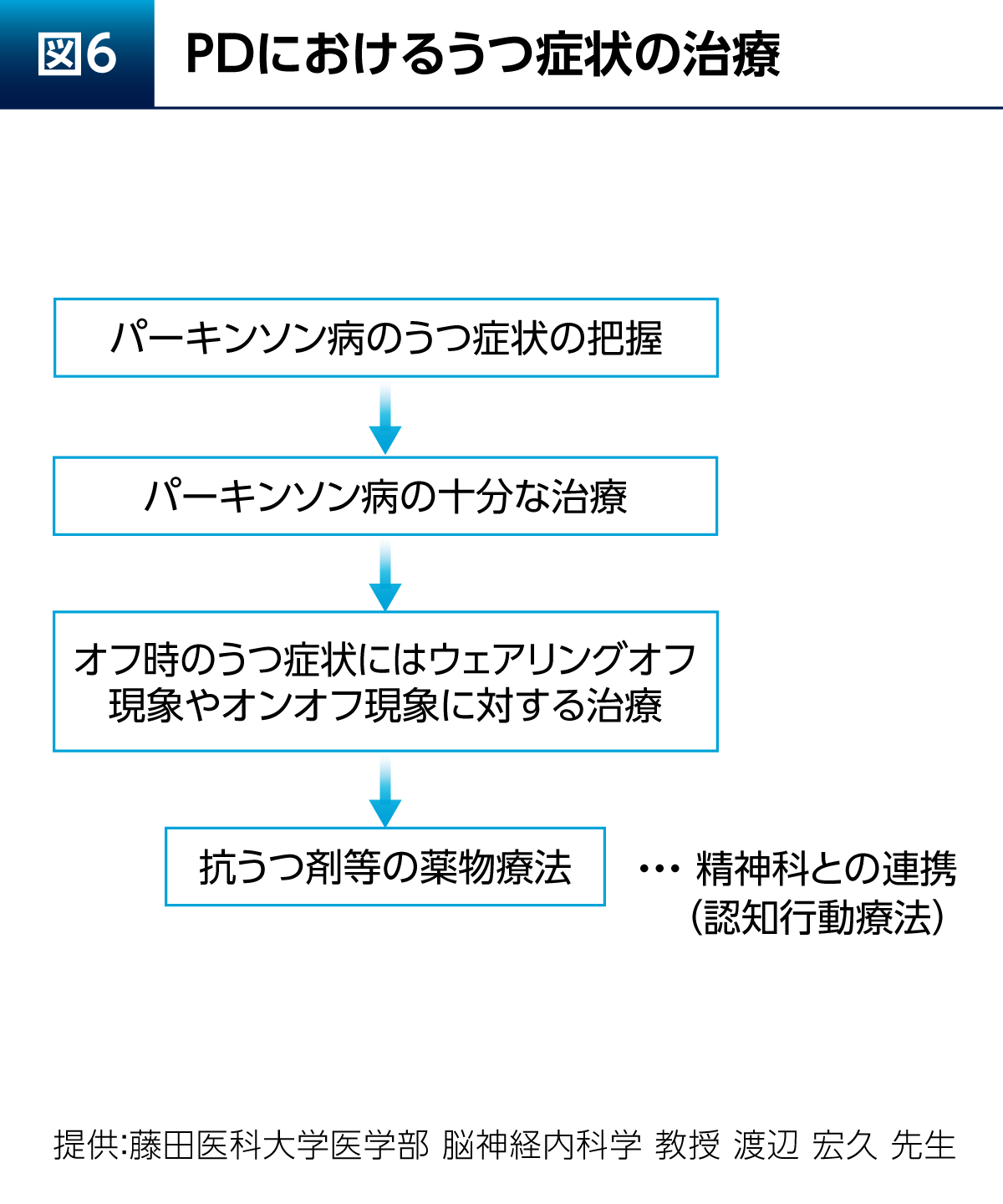
PDにおけるうつ症状の治療について考えてみたい。PDにおけるうつ症状の特徴として、うつ症状と関連する脳の領域にPDに伴う病理学的変化としての病変が出現する。将来への悲観や喪失感といった反応性のうつ症状もある。また、PDにおいて特徴的であるアパシーについて考慮することも重要である11)。
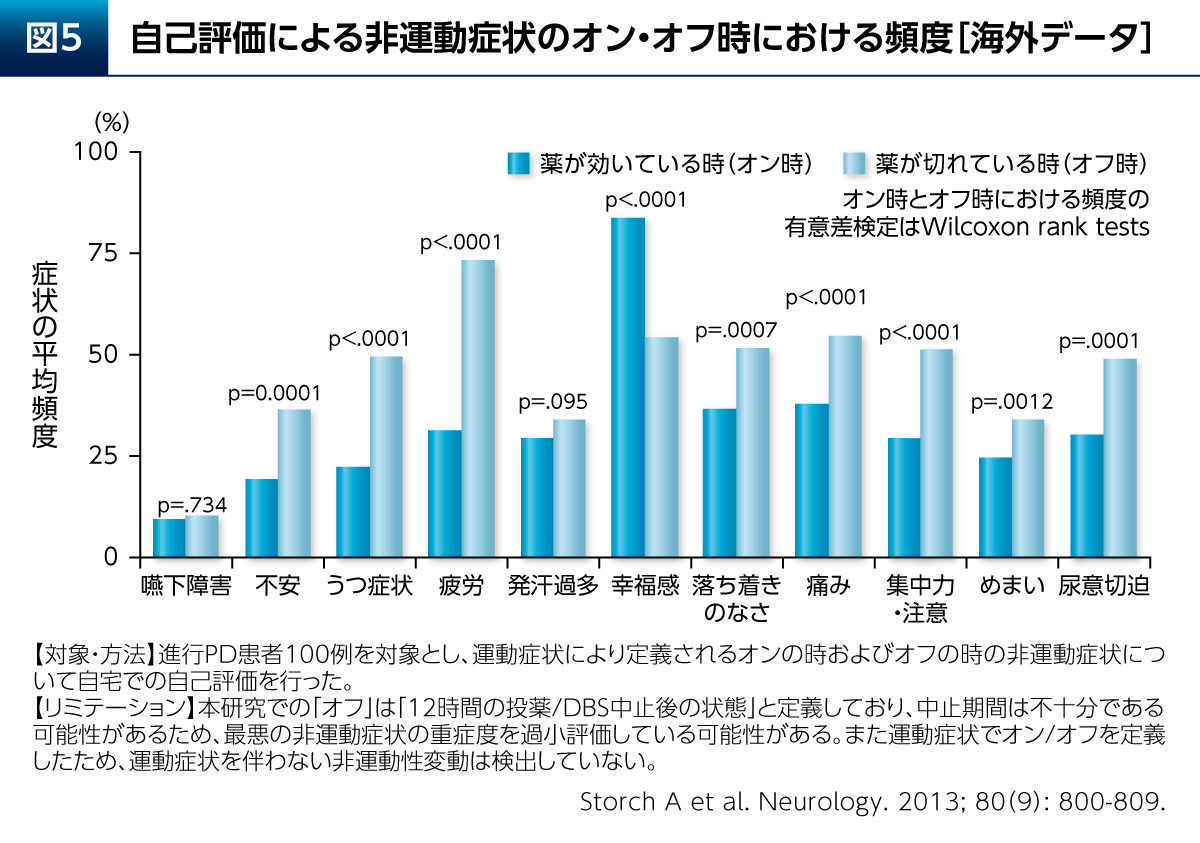
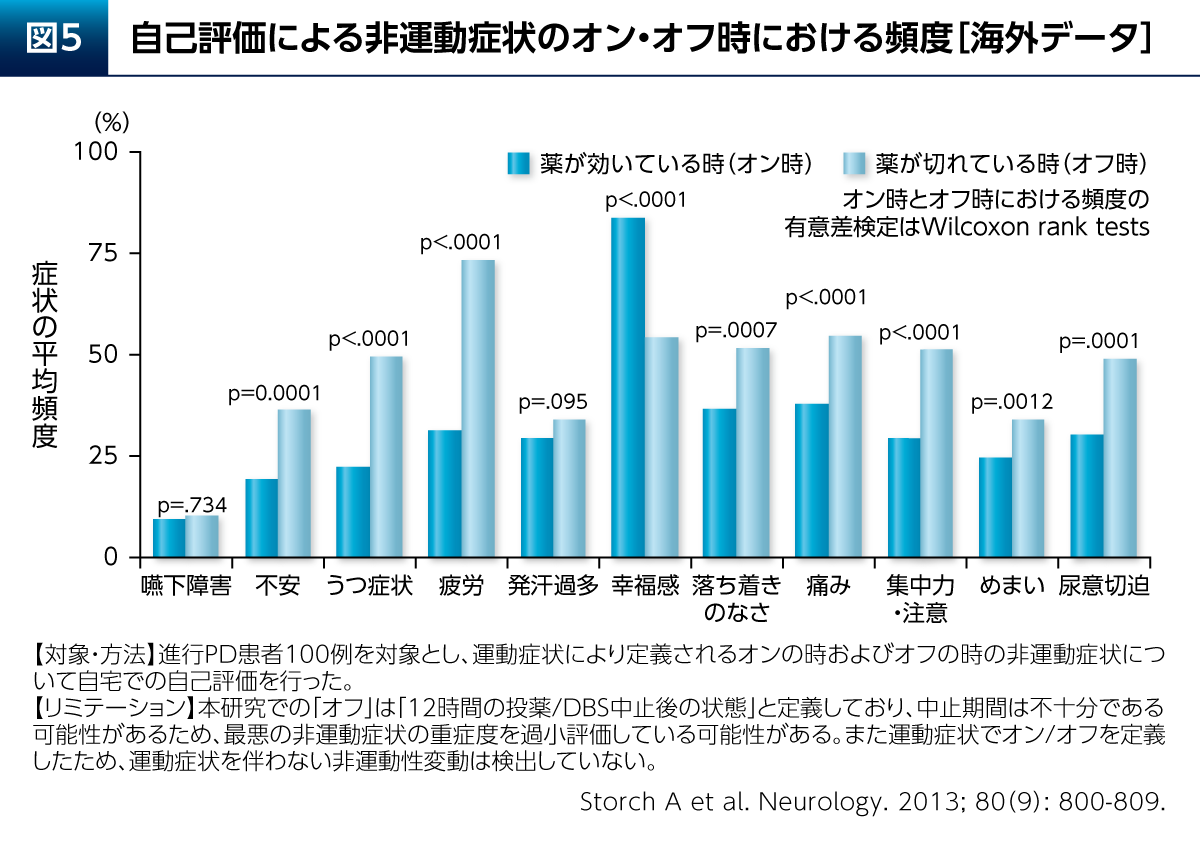
さらに、PDにおけるうつ症状は、薬が切れているオフ時に増悪するという特徴もある。進行期PD患者さん100例を対象とした検討からは、不安、うつ症状、疲労といった非運動症状の頻度はオン時よりもオフ時において有意に高いことが報告されている(図5)12)。よって、PDの治療を十分に行うことが当然ながら重要となる。
PDにおけるうつ症状を治療する際は、どのようなうつ症状であるかを把握した上で、PD自体の十分な治療を行い、運動合併症の対策を行う(図6)。そして、必要があれば抗うつ剤などによる薬物治療、認知行動療法を含む精神科との連携を行う。
認知行動療法をPD患者さんに対して適切に実施するには専門家に依頼する必要があるが、われわれのような脳神経内科医がPD患者さんにアプローチする際にも役立つ考え方がある13)。まず、「こころの教育」として現実世界と心の世界を理解してもらい、自らの言葉で自分自身に話していただいたり、外来で一緒に考える時間を取る。そうすることで感情によってもたらされる体の不快感を止める方法を患者さんと一緒に考えることができる。自らの言葉で自分自身に話すことで、感情や心の叫びがわかるようになる。
次に、「こころの方程式」として、不安の構成要素や対応を考えることで、行動をうまくコントロールする方法がある。例えば、緊張、PDの進行への不安、不眠などに対して、「戦うのか・待つのか・避けるのか」の3つの行動様式を患者さんと一緒に考えることも有益である。最近は、PD患者さんの不安とうつ症状について、ストレッチおよびレジスタンストレーニングに対するマインドフルネスヨガの有用性も報告されている(8週時、不安症状:p=0.001、うつ症状:p<0.001、一般化推定方程式モデル)14)。さらに、遠隔リハビリテーションにおいてAIやIoTの活用が進み、バーチャルの世界からの介入を通じて、PD患者さんが社会的に引きこもることを防げる可能性がある。
Emotional well-beingの向上をめざした社会へのアプローチ
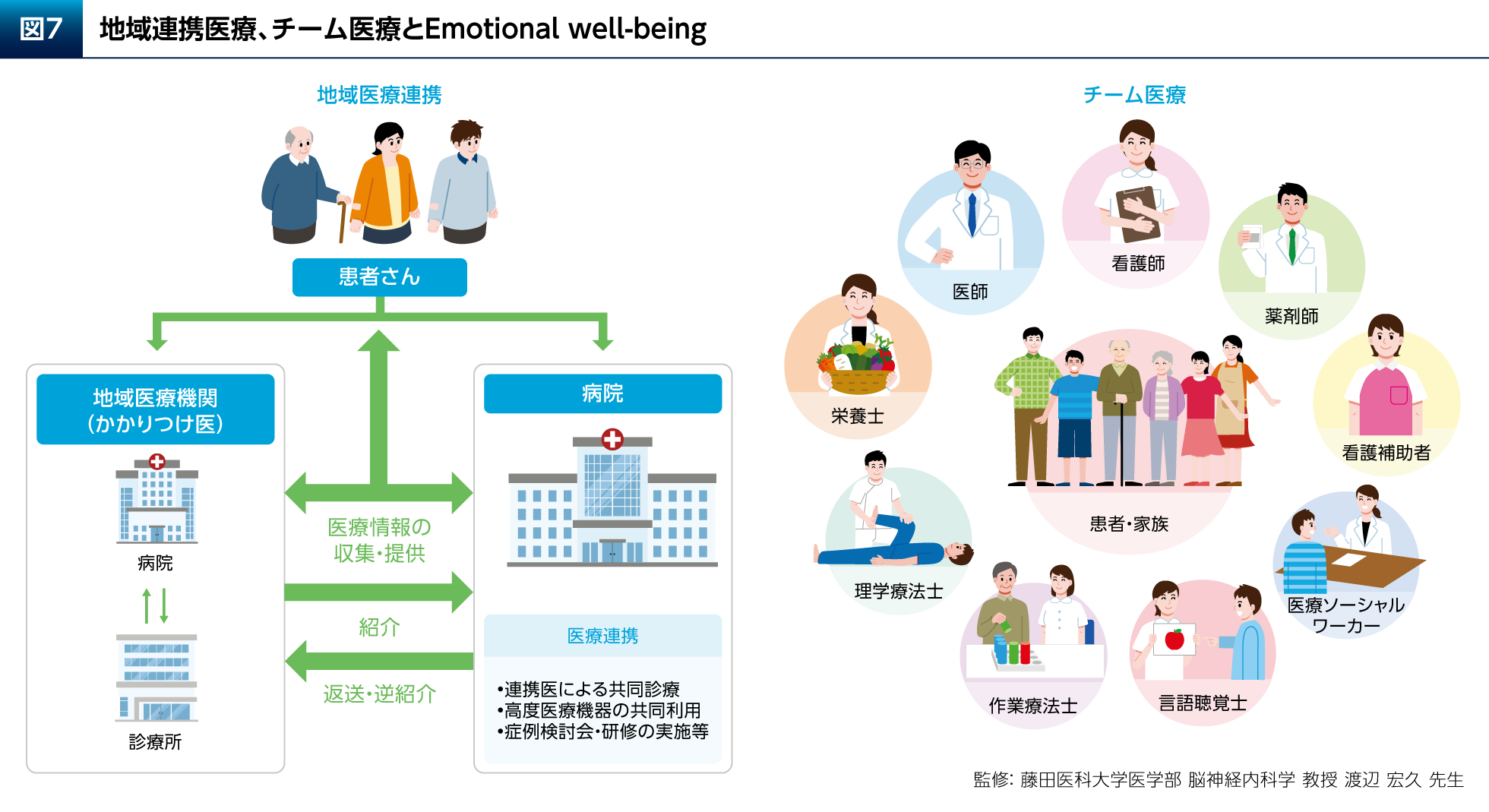
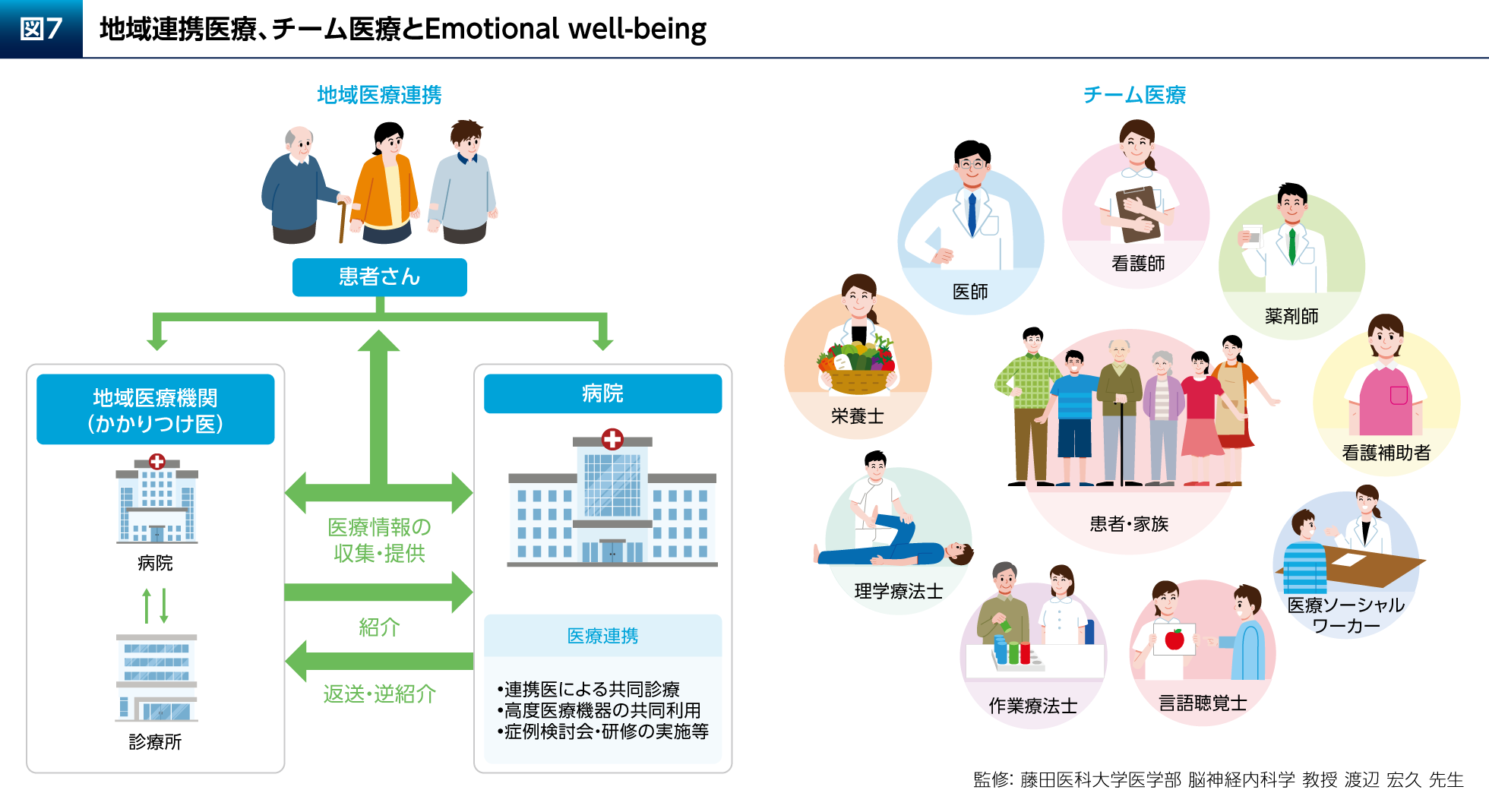
最後に、PD患者さんのEmotional well-beingを高めるために、どのように広く社会にアプローチすべきかについて考えたい。まず重要なのは、地域医療連携とチーム医療である(図7)。これらの診療体制により、病歴や身体所見からの問題点の早期発見、身体障害や合併症の適切な管理、多彩な非運動症状の適切な管理、非薬物療法や生活の工夫についての教育・情報提供が可能となる。学際的チームによるケアによってPD患者さんのPDQ-39 Summary Indexが、標準的な神経学的治療を行う対照群と比較して向上することを検証した無作為化比較試験も報告されている(p=0.044、分散分析)15)。
また、PD患者さんの生活環境や労働環境の改善をサポートするためには、多くの考えるべきことがある。PD患者さんの就労をサポートするために必要なこととして、European Parkinson’s Disease AssociationのWebサイトには、仕事の環境、職場への移動と職場における移動、疲労の蓄積や感情的・心理的ケアに対する具体的な取り組みがあげられている16)。このように医療従事者だけでなく、家族や周囲の多くの人々を巻き込んで、患者さん中心のケアを提供することがPD患者さんのEmotional well-beingを向上するためには欠かせない。高齢のPD患者さんにおいては、PDQ-39サブドメインの中でEmotional well-beingの不良が低栄養と最も強く関連していることからも(p<0.001, 多変量共分散分析※)17)、栄養を十分に管理できるスタッフのチーム医療への参画も重要である。
われわれの大学病院ではパーキンソン病センターを開設し、診療科・部門を越えてPDの診断・治療・研究を総合的に行っている。さらに、海外ではより強固なチーム医療であるMultimodal Complex Treatmentsが構築されている。多職種のスタッフにより、理学療法、マッサージ・温熱療法、作業療法、音声言語療法をはじめとする幅広い治療を提供することが重要である(表2)18)。


今後は、よりサイエンスに根ざした個別化医療と患者中心医療を推し進めることが重要である。そして、このことがPD患者さんの身体的、精神的および社会的な要素の充実とEmotional well-beingの向上につながると考えている。
※ 年齢、罹病期間、NMS-Questスコア、MDS-UPDRS Ⅲスコアで調整
参考文献
1)Constitution of the World Health Organization
https://www.who.int/about/governance/constitution(2022/7/28参照)
2)Bert Spilker Ed. Quality of Life and Pharmacoeconomics in Clinical Trials 2nd Edition. Lippincott Williams & Wilkins, 1996.
3)Tirado-Valencia P et al. Front Psychol. 2021; 12: 741897.
4)van Leeuwen M et al. Health Qual Life Outcomes. 2018; 16(1): 114.
5)河本純子 他. 臨床神経学. 2003; 43(3): 71-76.
6)Rajiah K et al. Neuroepidemiology. 2017; 48(3-4): 131-137.
7)Jones JD et al. Parkinsonism Relat Disord. 2014; 20(11): 1236-1241.
8)Chuquilín-Arista F et al. Brain Sci. 2021; 11(6): 771.
9)Watanabe H et al. Mov Disord Clin Pract. 2020; 7(4): 431-439.
10)Koerts J et al. Parkinsonism Relat Disord. 2016; 27: 9-24.
11)Pagonabarraga J et al. Lancet Neurol. 2015; 14(5): 518-531.
12)Storch A et al. Neurology. 2013; 80(9): 800-809.
13)Shinmei I et al. Neuropsychiatr Dis Treat. 2016; 12: 1319-1331.
14)Kwok JYY et al. JAMA Neurol. 2019; 76(7): 755-763.
15)Eggers C et al. J Neurol. 2018; 265(4): 764-773.
16)European Parkinson's Disease Association
https://www.epda.eu.com/living-well/wellbeing/work-finance-and-legal/work(2022/7/28参照)
17)Gruber MT et al. PLoS One. 2020; 15(5): e0232764.
18)Scherbaum R et al. J Neurol. 2020; 267(4): 954-965.
講演3 QOLを考慮したこれからのパーキンソン病治療について


価値(Value)に基づく医療(VBM)の重要性
2018年に発刊された「パーキンソン病診療ガイドライン2018」1)においては、治療ガイドラインから診療ガイドラインになったことによる改訂に加え、エビデンスに対する考え方が前回の版から大きく変わっている。
以前の考え方は、エビデンスレベルが高いほど治療の推奨レベルも高いというエビデンス万能主義であった。一方、2018年版ではMinds 2014により推奨されているGRADEシステムが導入された。
このGRADEシステムは、エビデンスの質の評価と治療の推奨度を分けて考えるものである。エビデンスの質はA~Dの4段階に分けられるが、推奨の強さについては1(強い)と2(弱い)の2段階しかない(表1)。エビデンスの質が高いからといって、その治療の推奨度が必ずしも高くなるわけではなく、GRADE 1DよりもGRADE 2Aの方が推奨度としては低い。


エビデンスとは評価された測定値の科学的な改善の証拠である。この評価される測定値は必ずしも治療の価値に基づいて設定されてはいないことから、エビデンスが治療の価値を決定するわけではない。「価値」とは、人生の価値のように個人差が大きいものであり、主観的評価にならざるを得ない。根拠に基づく医療(Evidence-Based Medicine:EBM)は1980年代後半に主に米国で始まったものであるが、この上に治療の意義や価値を決定する価値判断が必要である(図1)2)。この価値判断も考慮し、元気に楽しく生きるという究極の目標をめざすのがValue-Based Medicine(VBM)である。価値には経済的価値と主観的価値があるが、主観的価値を測定するものの代表がQOLである。QOLは個人特性に影響されることから、Patient Reported Outcome(PRO)として測定され、近年、PROは医療における治療介入の評価尺度として非常に注目されている。
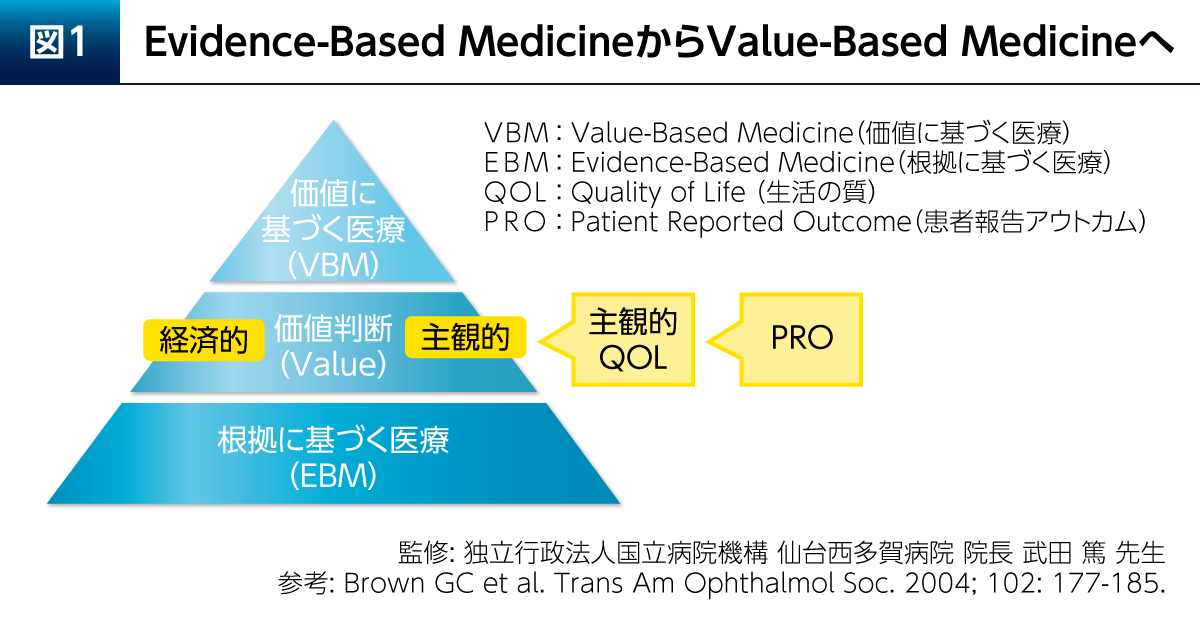
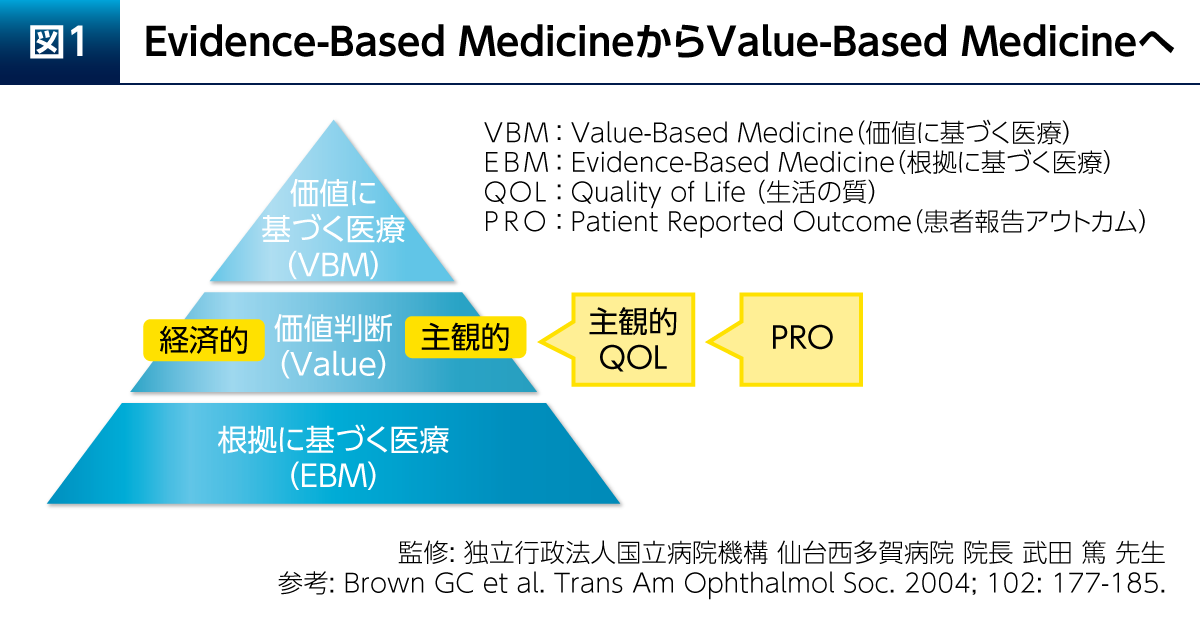
PD患者さんにおけるQOL
健康関連QOLを評価する尺度には疾患横断的な包括的尺度(SF-36、EQ-5Dなど)と疾患特異的尺度がある(表2)。パーキンソン病(PD)に特異的な尺度としては、Parkinson's Disease Questionnaire(PDQ)-39やその短縮版であるPDQ-8が一般的に用いられる。PDQ-39は運動能、日常生活活動(ADL)、情緒安定性(Emotional well-being)などの8つのドメインに分類される39の質問項目からなる(表3)3)。
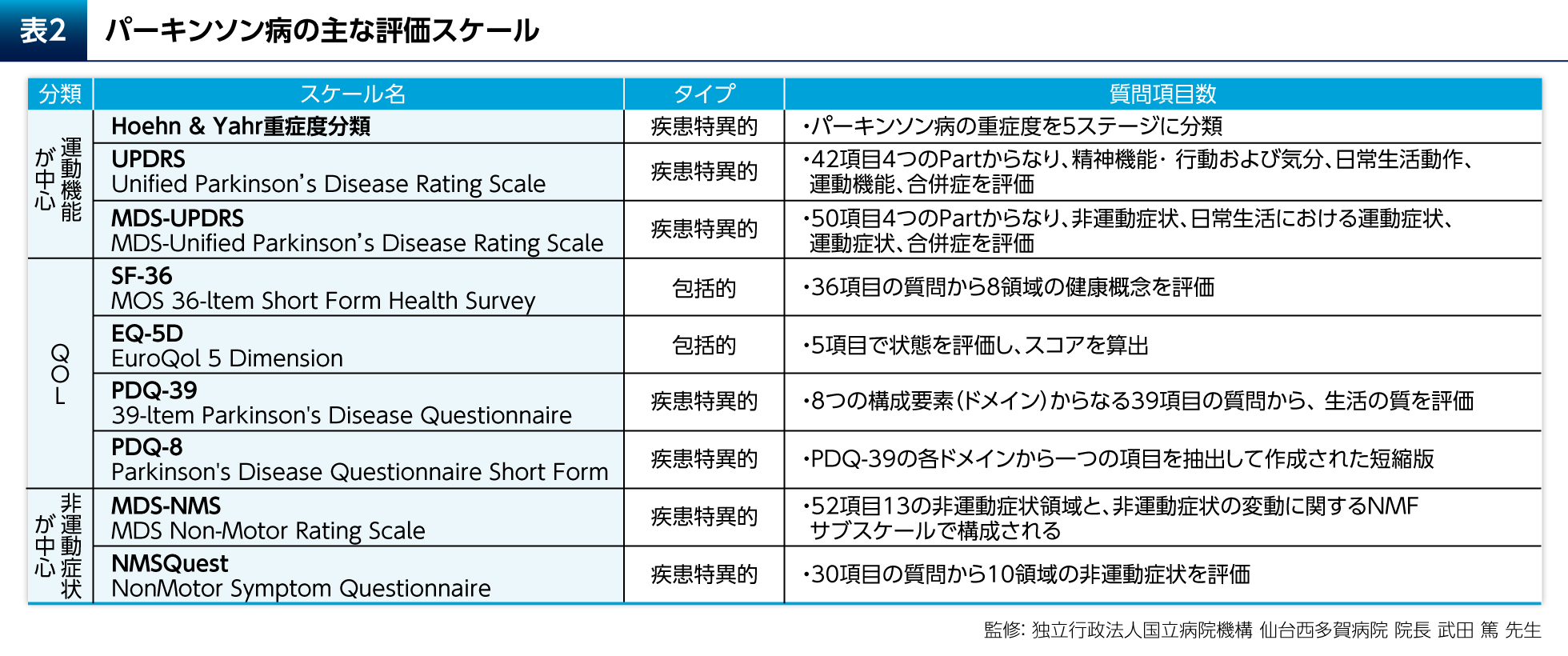
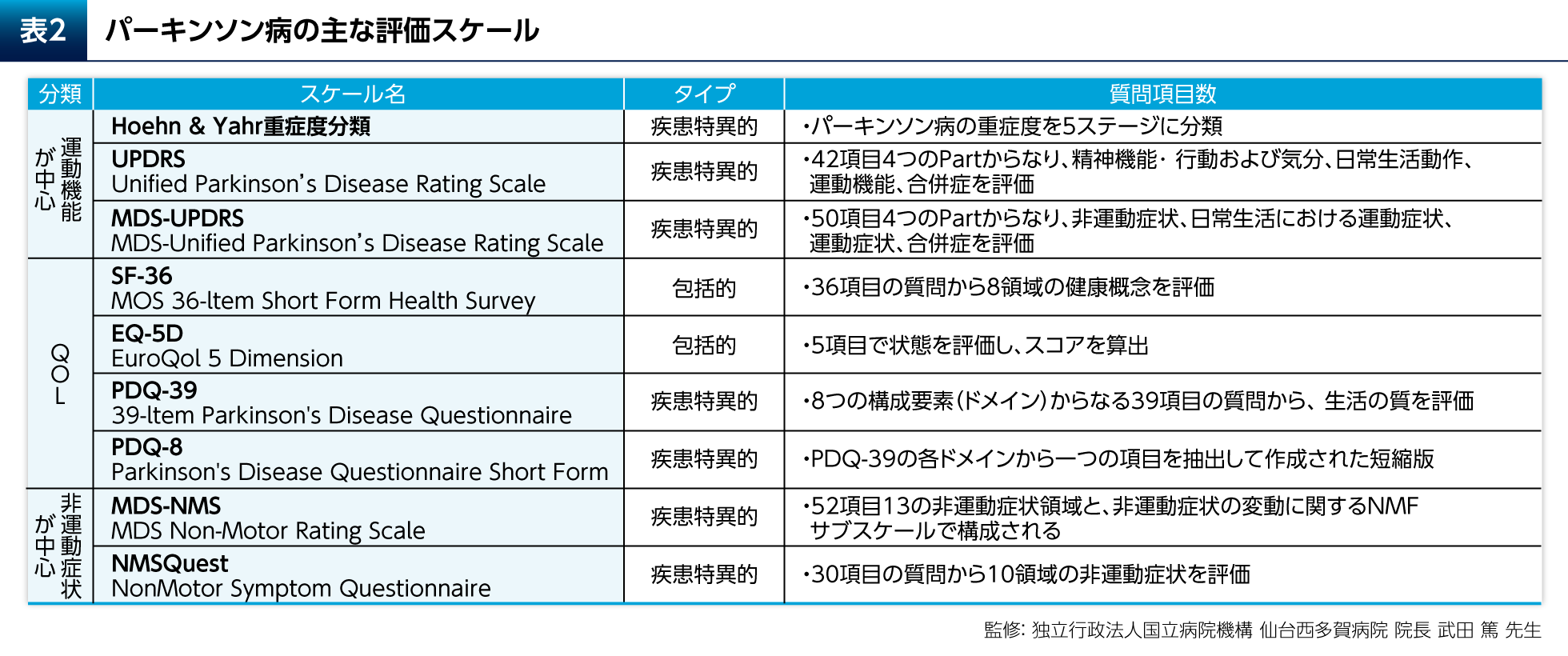
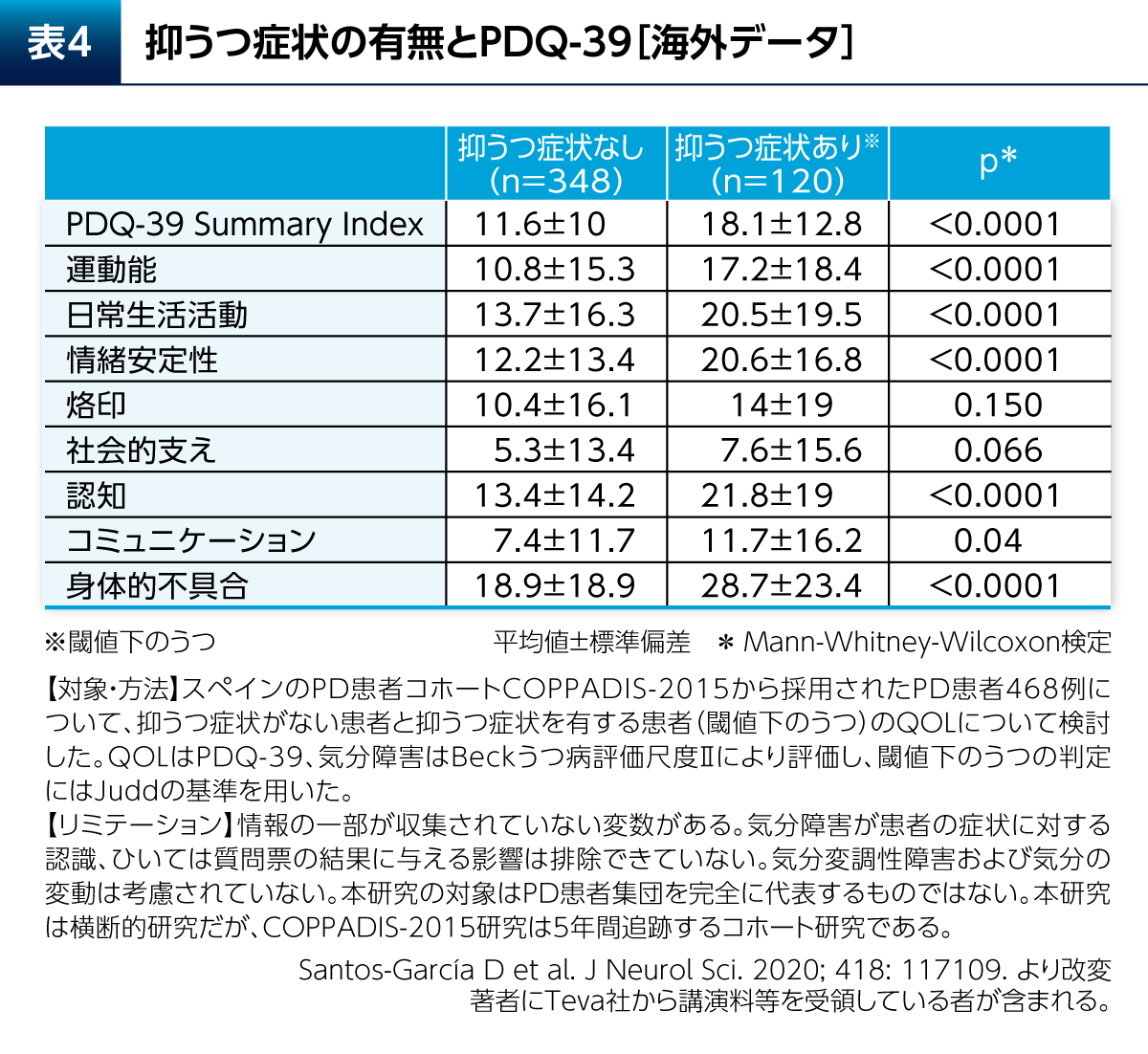
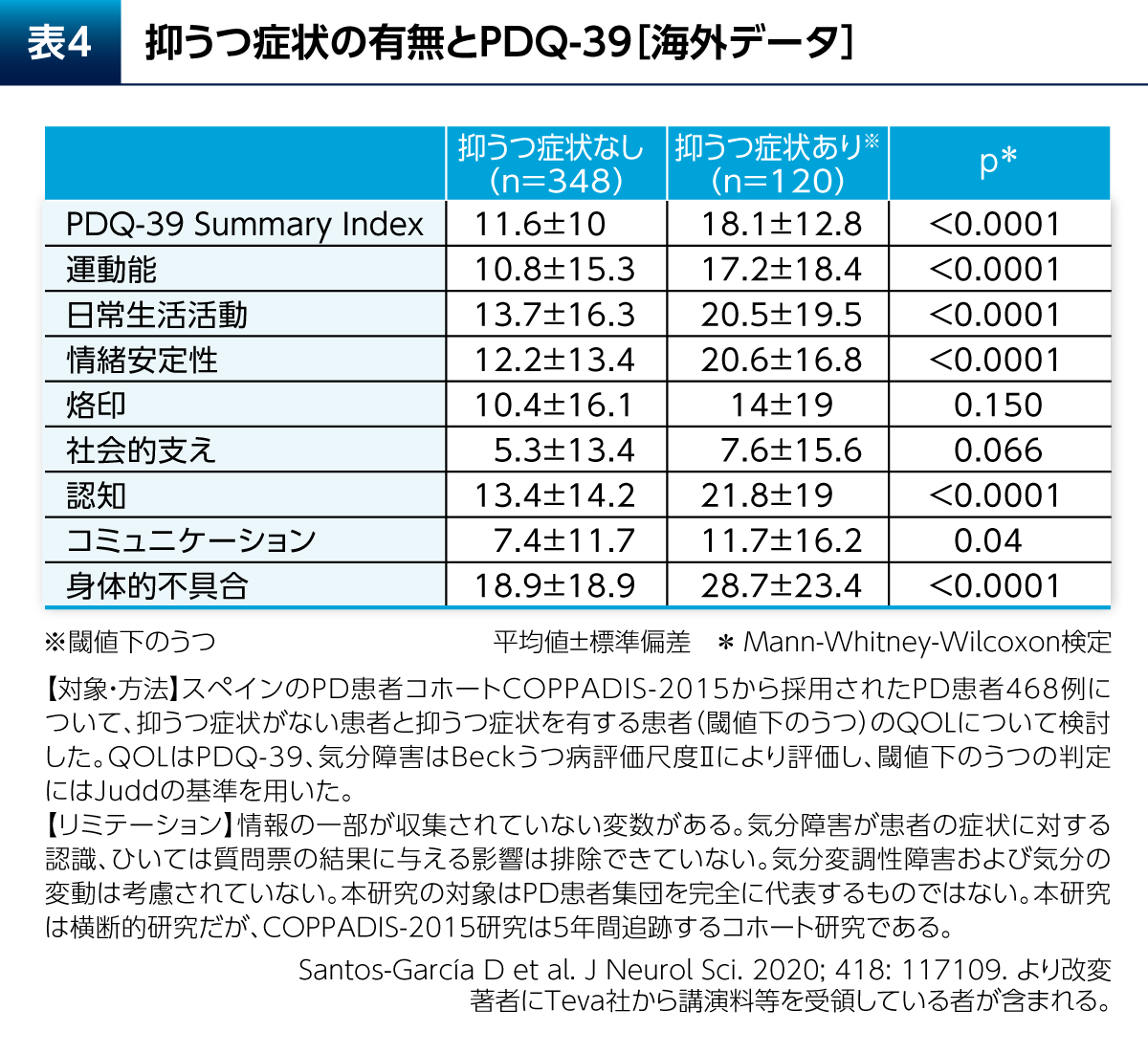
PD患者さんではQOLが低下しており、健常者と比較してPDQ-39 Summary Indexに関して有意差が認められたことがメタ解析により示されている(p<0.001、Q検定およびI2検定)4)。抑うつはPD患者さんのQOLに大きく影響する。抑うつ症状を有するPD患者さん(閾値下のうつ:subthreshold depression)では、抑うつ症状を有さないPD患者さんと比較してPDQ-39のSummary Indexが有意に高く、運動能やADL、Emotional well-beingなどのドメインについても有意差が認められたことが報告されている(表4)5)。
非運動症状がPD患者さんのQOLに大きく影響する
運動症状はPDの症状のごく一部であり、きわめて多彩な非運動症状(抑うつ、認知症、睡眠障害、便秘、嗅覚低下、自律神経症状など)があることから、「パーキンソン複合体」という概念が提唱されている6)。
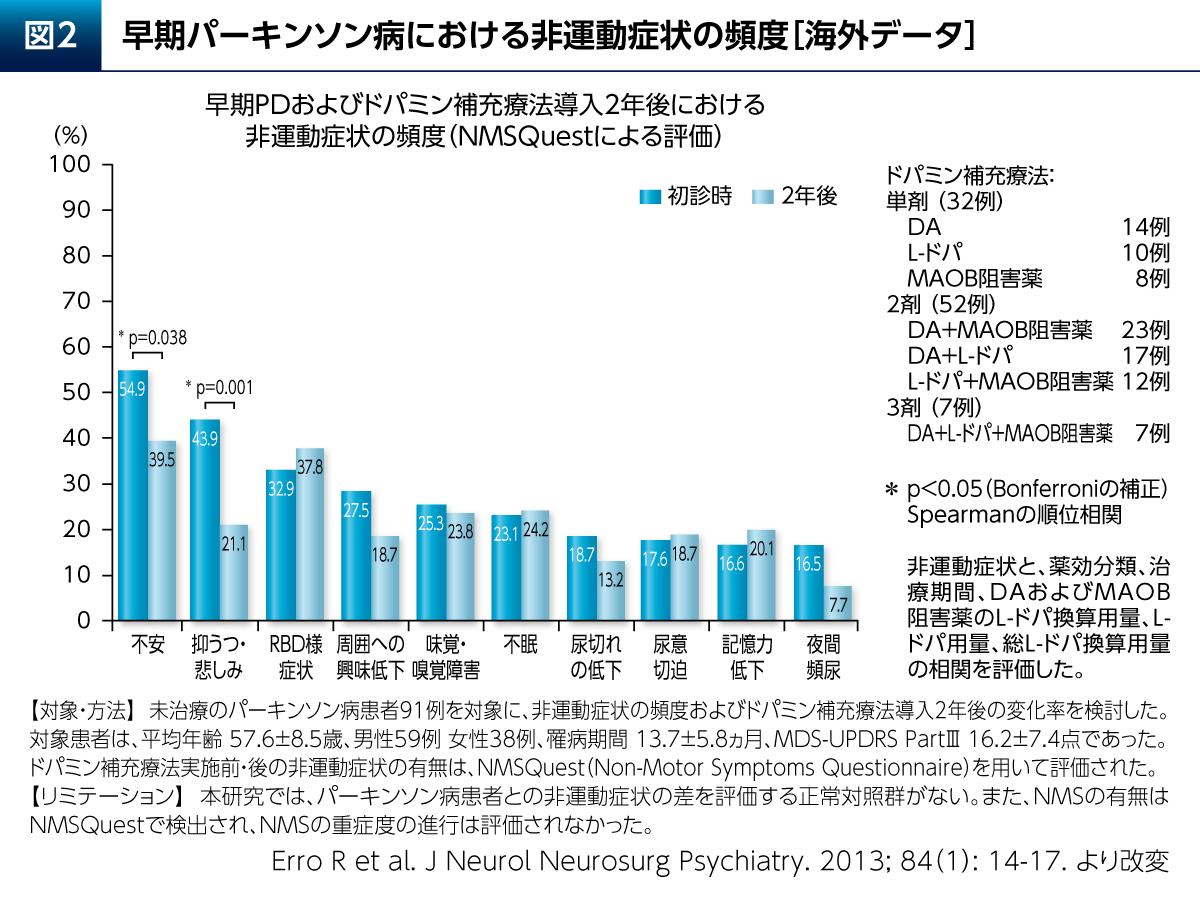
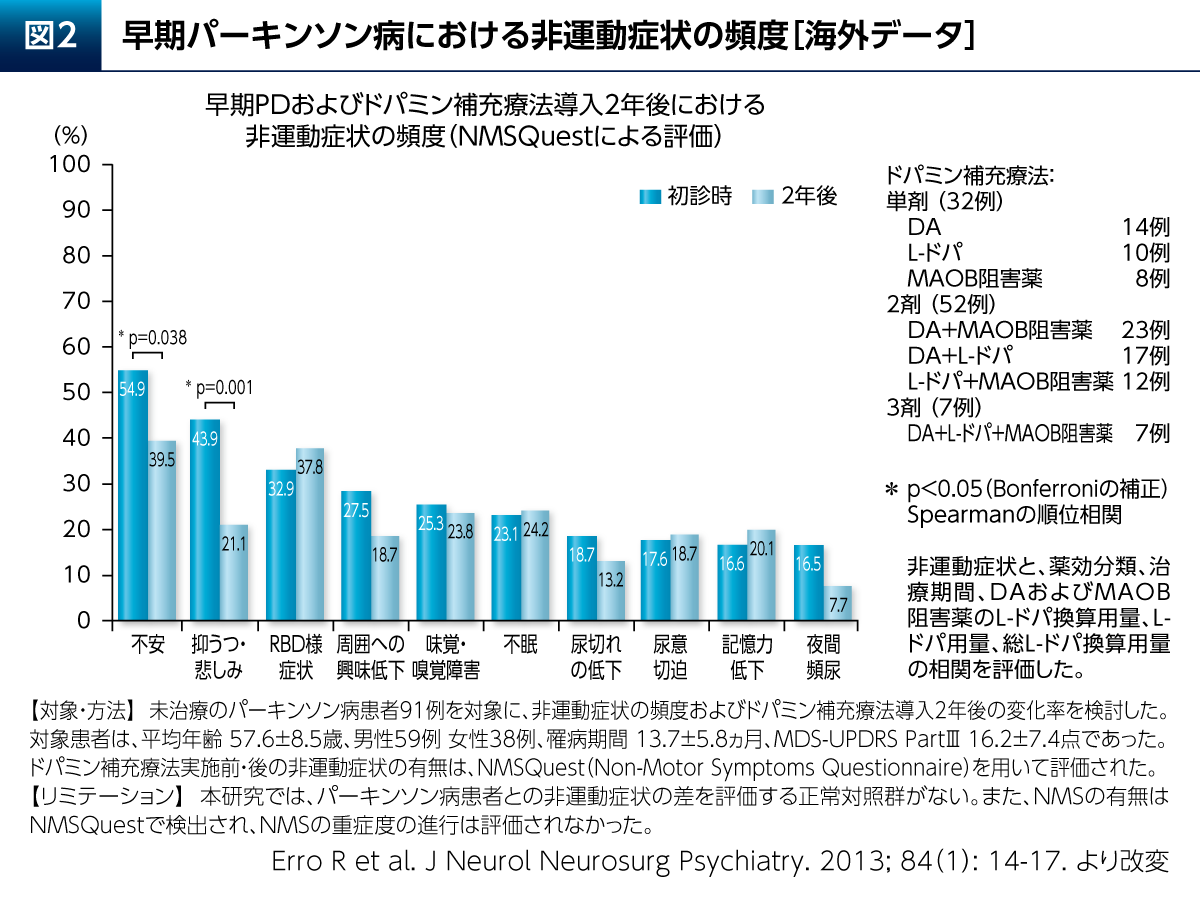
PDの非運動症状を評価する尺度であるNon-Motor Symptoms Questionnaire(NMSQuest)を用いて、未治療のPD患者さんにおける非運動症状の頻度を検討した結果、初診時においては約半数の患者さんが不安と抑うつ・悲しみの症状を有していたことが報告されている(図2)7)。2年後においては各症状の頻度に変化がみられたが、不安と抑うつ・悲しみについては有意に頻度が低下していた。よって、ドパミン補充療法はPD患者さんの情動に対しても影響を及ぼすことが示唆される。
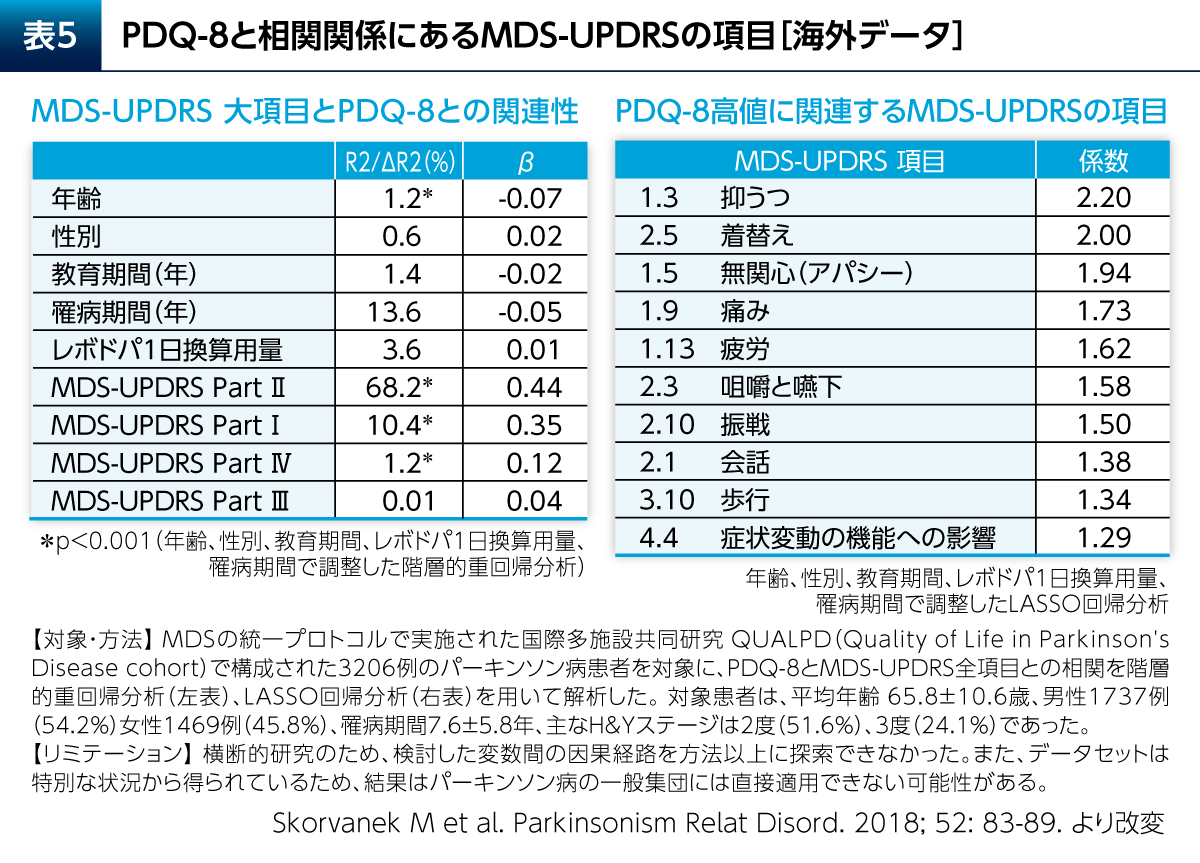
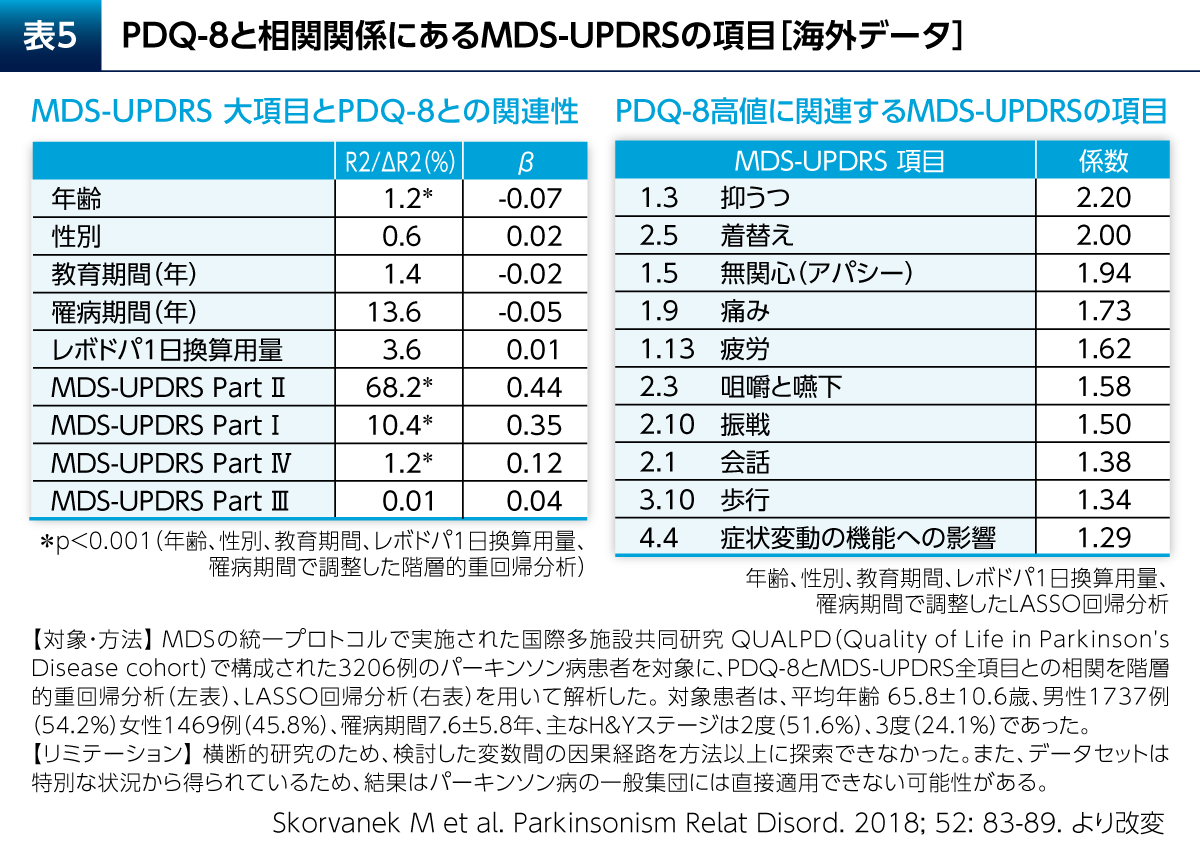
PD患者さんのPDQ-8に影響を及ぼす因子について検討した研究が報告されている(表5)8)。これによると、MDS-UPDRSのPart Ⅲ(運動症状)やPart Ⅳ(運動合併症)よりも、Part Ⅱ(ADL)とPart Ⅰ(非運動症状)がPDQ-8に強く関連していた。一方で、これまでMDS-UPDRSの中で最も重要と考えられてきたPart ⅢはPD患者さんのQOLへの影響が最も小さいことが示唆される結果であった。MDS-UPDRSの下位項目では、抑うつ、着替え、無関心(アパシー)といった気分障害やADLに関する項目がPDQ-8に強く関連していた。
ここでPDの評価尺度であるMDS-UPDRSの内容を改めてみてみたい(表3)9)。PD患者さんのQOLに強く関連していることが示唆されたPart Ⅰは従来のUPDRSよりも拡充されて13項目となっている。
うち6項目は医師の面接により評価される項目(認知、幻覚、抑うつなど)であるが、7項目は患者さん自身が回答するPROである(睡眠の質、日中の眠気、便秘、疲労などについて回答)。PD患者さんのQOLに最も強く関連していることが示唆されたPart Ⅱの13項目はいずれもPROであり、会話、唾液とよだれ、咀嚼と嚥下、身の回りの清潔、書字、趣味や娯楽といったADLが評価される。一方、QOLへの影響が少ないことが示唆されるPart ⅢとPart Ⅳは全て医師の面接により評価される項目である。Part Ⅲは18項目からなるが、手の動きに関する項目はわずか3項目であり、振戦の評価や体幹および下肢に関する項目が大部分を占めている。このように偏った評価になっているのは、UPDRSが作成された際に複数の脳神経内科医が評価を行って評価にぶれが少なかった項目が選択されたことを反映されている。よって、Part Ⅲは客観性と信頼性が高い指標である反面、患者さんにとってのメリットが十分に反映されていない可能性が考えられる。
治療介入によるQOLへの影響
PD患者さんのQOLに薬物治療が及ぼす影響は多くの臨床試験で検討されており、L-ドパ、ドパミンアゴニストおよびMAO-B阻害薬のいずれについてもPDQ-39またはPDQ-8のスコアの減少が報告されている10)。
MAO-B阻害薬ラサギリンによるPD患者さんの非運動症状およびQOLへの影響は、日本人の早期PD患者さんを対象とした第Ⅲ相検証試験により示されている11)。
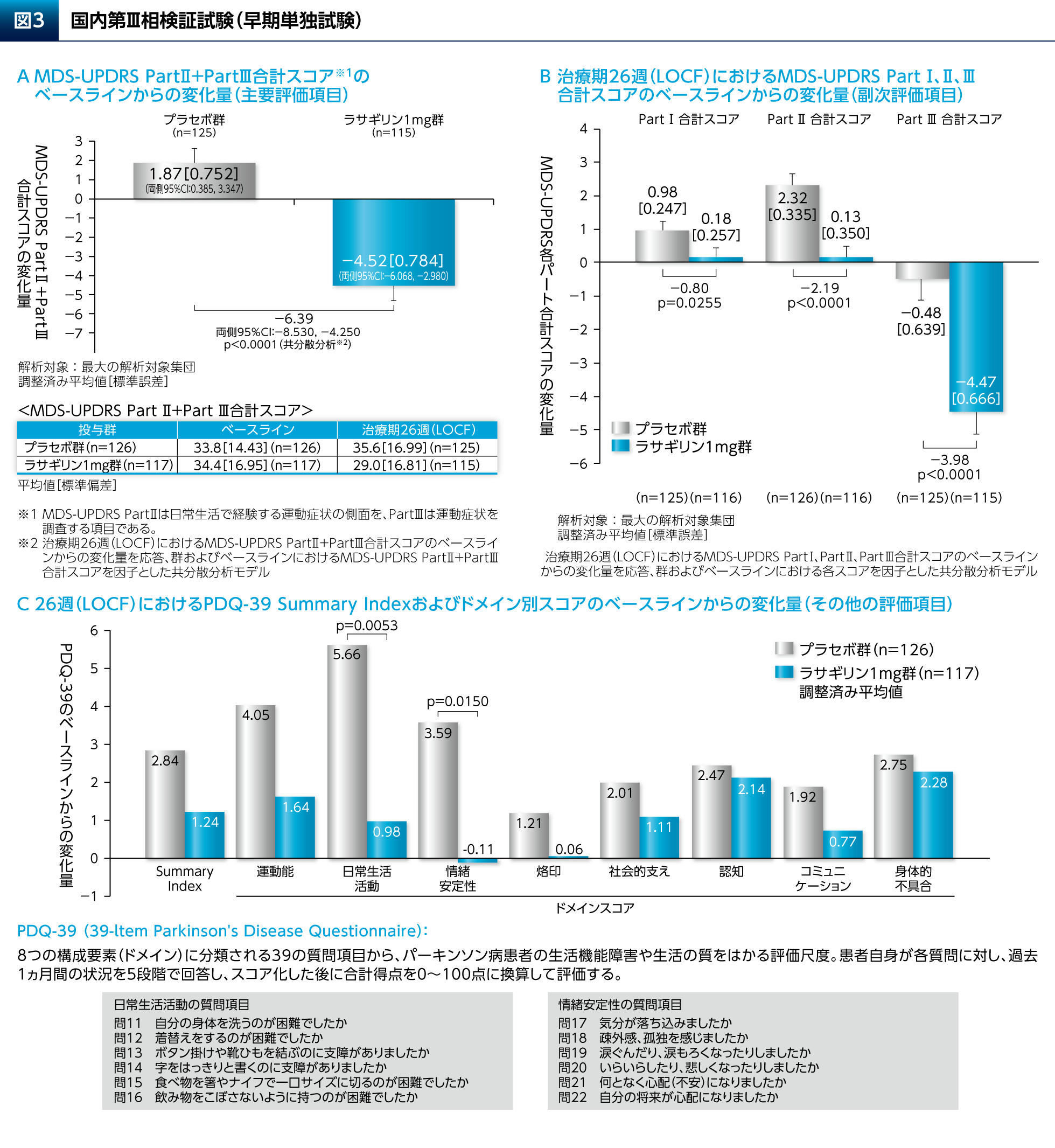
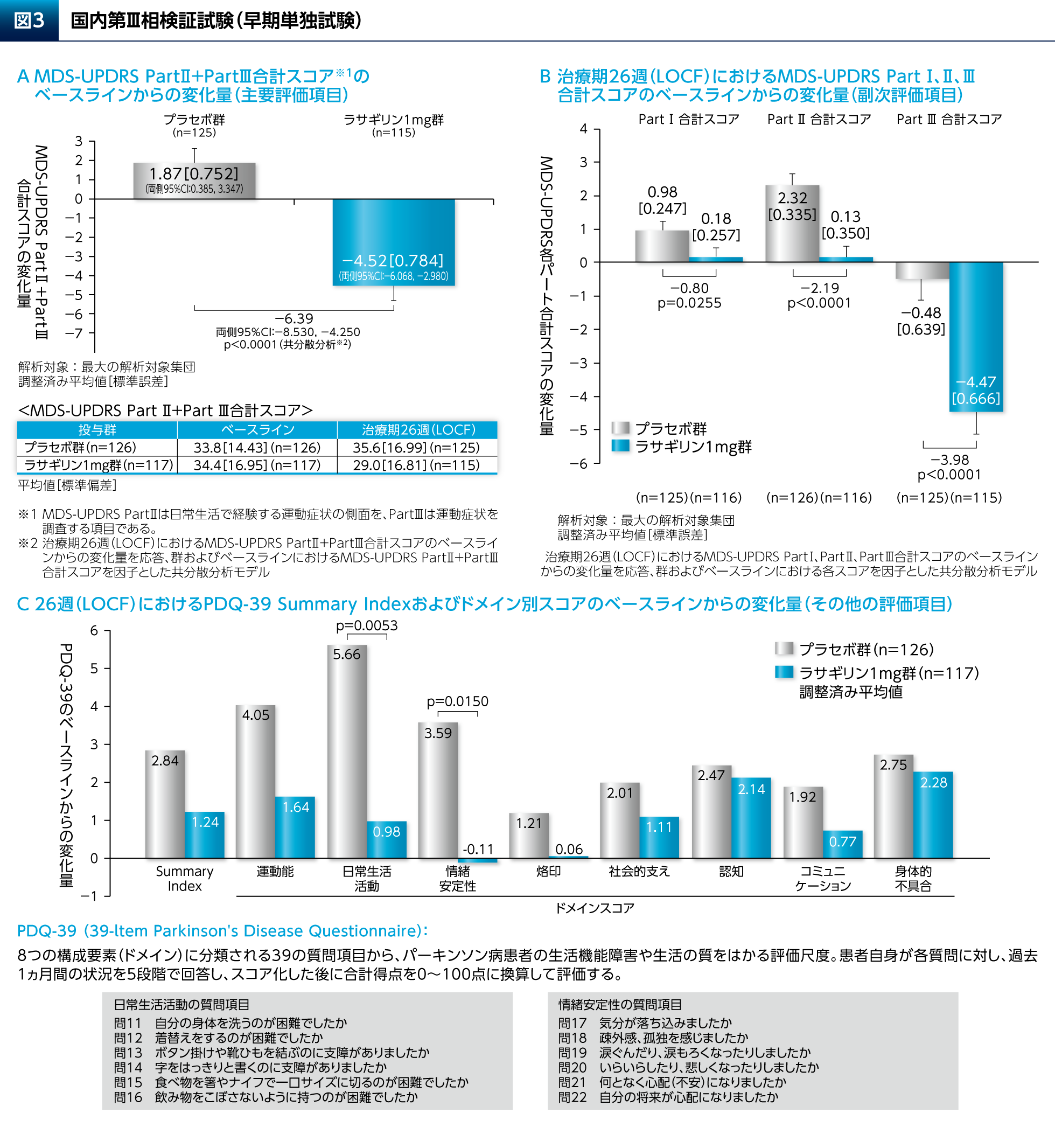
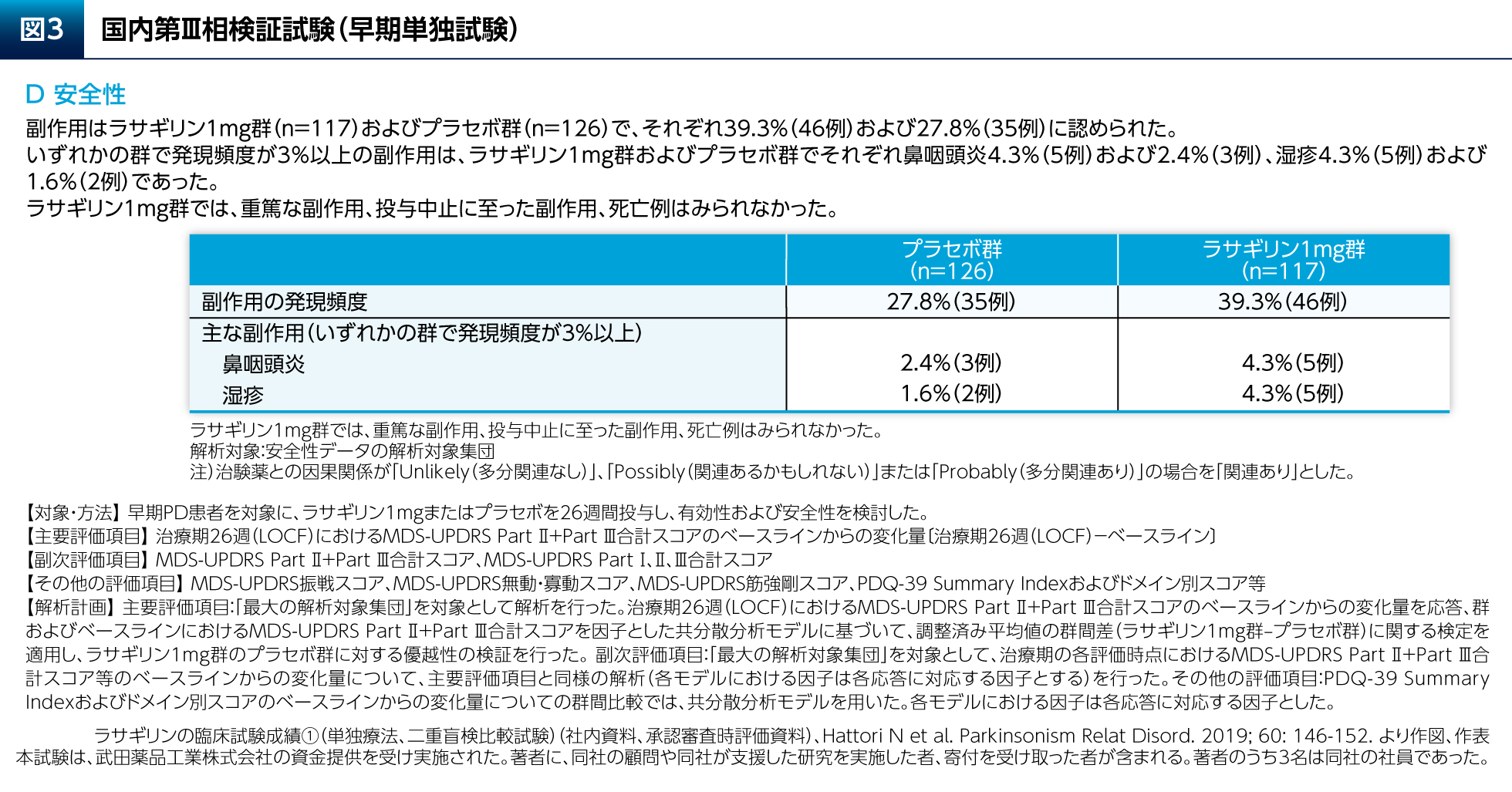
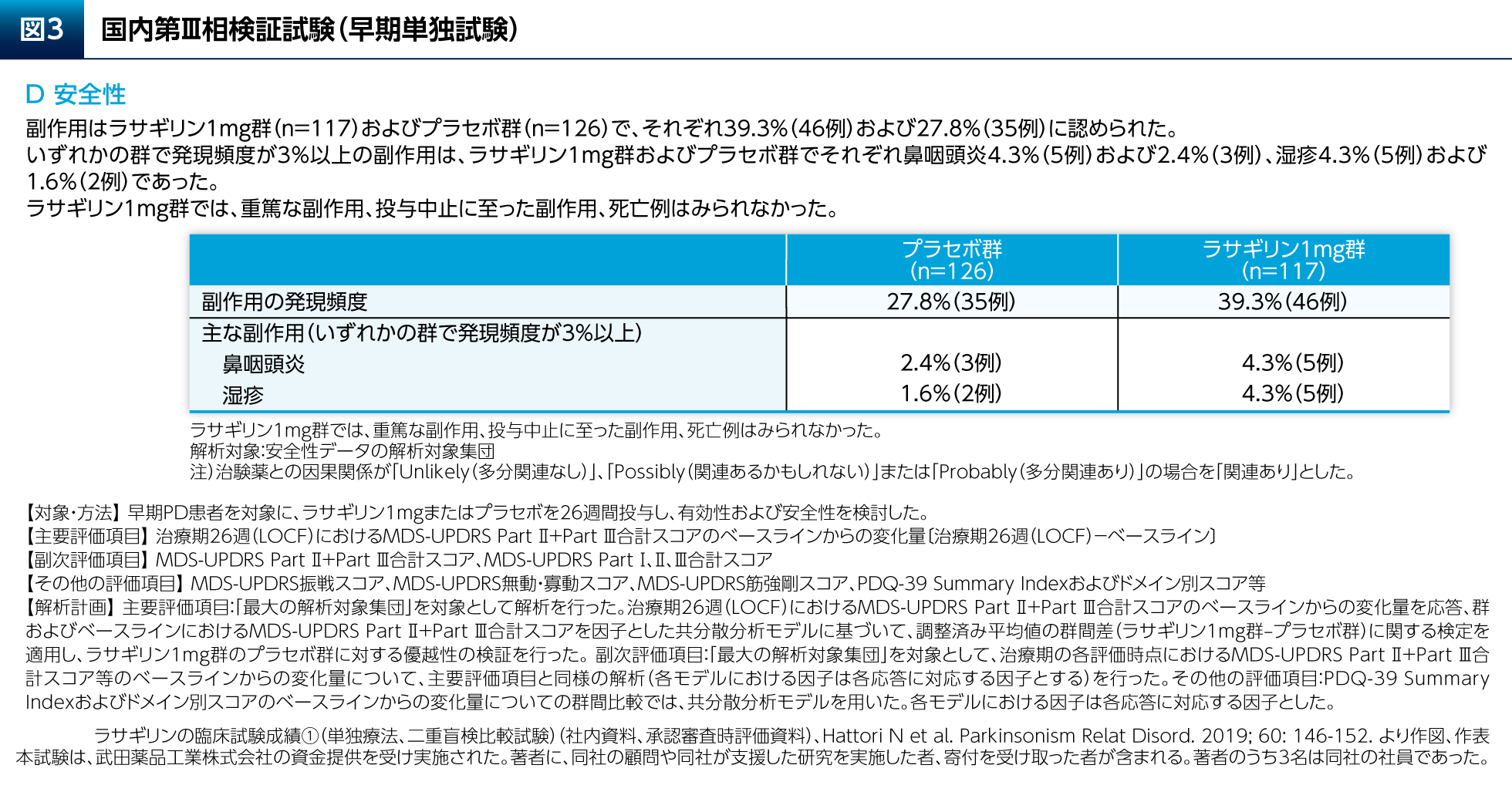
本試験において、ラサギリン1mg群ではプラセボ群と比較して、主要評価項目のMDS-UPDRS Part Ⅱ+Part Ⅲ合計スコアの有意な改善が認められただけでなく(図3A)、副次評価項目のMDS-UPDRS Part Ⅰ、Part ⅡおよびPart Ⅲの各合計スコアのいずれの変化量についても有意差が認められた(図3B)。PDQ-39のSummary Indexについて有意差は認められなかったが、日常生活活動および情緒安定性のドメインのスコアの変化量についてはラサギリン1mg群とプラセボ群との間に有意差が認められた(図3C)。副作用はラサギリン1mg群の39.3%(46/117例)に認められた(図3D)。
ウェアリングオフ現象を伴うレボドパ含有製剤併用の進行期PD患者さんを対象とした第Ⅱ/Ⅲ相二重盲検無作為化比較試験12)においても、ラサギリン1mg群(129例)ではプラセボ群(141例)と比較して、主要評価項目であるオフ時間の有意な短縮(p=0.0006、共分散分析※1)が認められただけでなく、PDQ-39のSummary Index(p=0.0012)、運動能(p=0.0056)、日常生活活動(p<0.0001)、情緒安定性(p=0.0303)および身体的不具合(p=0.0326)について有意差が認められた(共分散分析※2)。有害事象の発現頻度はプラセボ群50.4%(71/141例)、ラサギリン0.5mg群69.9%(93/133例)、ラサギリン1mg群73.6%(95/129例)であった。
運動療法によるPD患者さんのQOLへの影響についても多くの検討が行われている。メタ解析(20試験、合計1,143例)からは、運動によりQOLスコアが減少することや(p<0.001)、PDQ-39のドメインのうちの運動能(p<0.001)、日常生活活動(p=0.001)および社会的支え(p=0.020)のスコアも減少することが示されている(いずれもランダム効果モデル)13)。
1.※1治療期における1日あたりの平均オフ時間のベースラインからの変化量を応答(従属変数)、群およびベースラインにおける1日あたりの平均オフ時間を因子(説明変数)とした共分散分析モデル
2.※2主要評価項目と同様の共分散分析(各モデルにおける因子は各応答に対応する因子とした)
まとめ
治療介入による測定値の改善は患者さんにとっての価値と必ずしも一致しないため、EBMだけでなくVBMに基づく医療が重要である。PROにより評価される健康関連QOLは、患者さんにとっての治療の価値を評価する指標である。PD患者さんのQOLの評価にはPDQ-39やPDQ-8が用いられるが、抑うつなどの非運動症状とADLの障害がPD患者さんのQOLに影響すること、MDS-UPDRSのPart ⅢよりもPart ⅠとⅡの影響が大きいことが示されている。ラサギリンの2つの国内第Ⅲ相検証試験では、MDS-UPDRSのPart Ⅲだけでなく、Part ⅠやPart Ⅱ、PDQ-39においてもプラセボ群との間に有意差が示されている。早期および進行期の日本人PD患者さんを対象とした二重盲検無作為化比較試験において、主観的な指標であるPROが評価項目に採り入れられ、ラサギリン1mg群とプラセボ群との間に有意差が示された意義は大きいと考える。
参考文献
1)パーキンソン病診療ガイドライン2018, 医学書院, 2018
2)Brown GC et al. Trans Am Ophthalmol Soc. 2004; 102: 177-185.
3)河本純子 他. 臨床神経学. 2003; 43(3): 71-76 .
4)Zhao N et al. CNS Neurosci Ther. 2021; 27(3): 270-279.
5)Santos-García D et al. J Neurol Sci. 2020; 418: 117109.
6)Langston JW. Ann Neurol. 2006; 59(4): 591-596.
7)Erro R et al. J Neurol Neurosurg Psychiatry. 2013; 84(1): 14-17.
8)Skorvanek M et al. Parkinsonism Relat Disord. 2018; 52: 83-89.
9)近藤智善. 最新医学. 2010; 65(4): 856-860.
10)Martinez-Martin P et al. CNS Drugs. 2015; 29(5): 397-413.
11)Hattori N et al. Parkinsonism Relat Disord. 2019; 60: 146-152.
12)Hattori N et al. Parkinsonism Relat Disord. 2018; 53: 21-27.
13)Chen K et al. Parkinsons Dis. 2020; 2020: 3257623.
Closing Remarks 服部 信孝 先生 順天堂大学大学院 医学研究科 神経学 教授
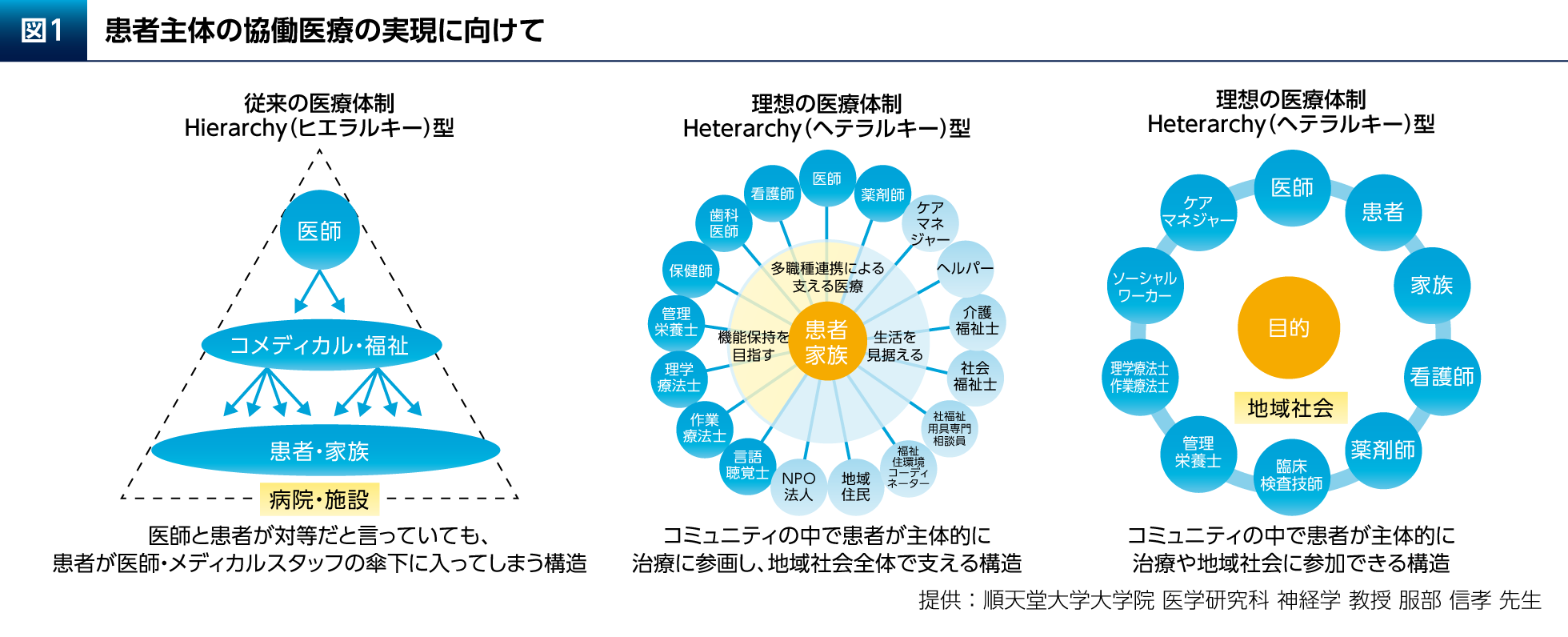
昨今の新型コロナウイルス感染症(COVID-19)のパンデミックによる社会環境の悪化は、PD患者さんの心理的ストレスと転帰の悪化の一因となる可能性が指摘されている1)。そのような中、本日のシンポジウムの講演3で武田先生がお話しになったPROによって評価されるPD患者さんのQOLを重視した医療と患者さん主体の協働医療を実践することが求められる。そのために重要となるのが、「へテラルキー型」の医療体制である(図1)。従来の医療体制は医師をピラミッドの頂点とする、いわば「ヒエラルキー型」であった。それに対し、「へテラルキー型」の体制では医療従事者だけでなく、ケアマネジャーなどの多くの職種がフラットな関係でPD患者さんとそのご家族を支える。地域社会のコミュニティの中でPD患者さんが主体的に治療に参画し、地域社会全体で支える構造である。
これからの時代のパーキンソン病診療に求められる脳神経内科医の在り方は「生活を看る」、「心を視る」、「家族を観る」という3つの目を持つことが重要と考えている。
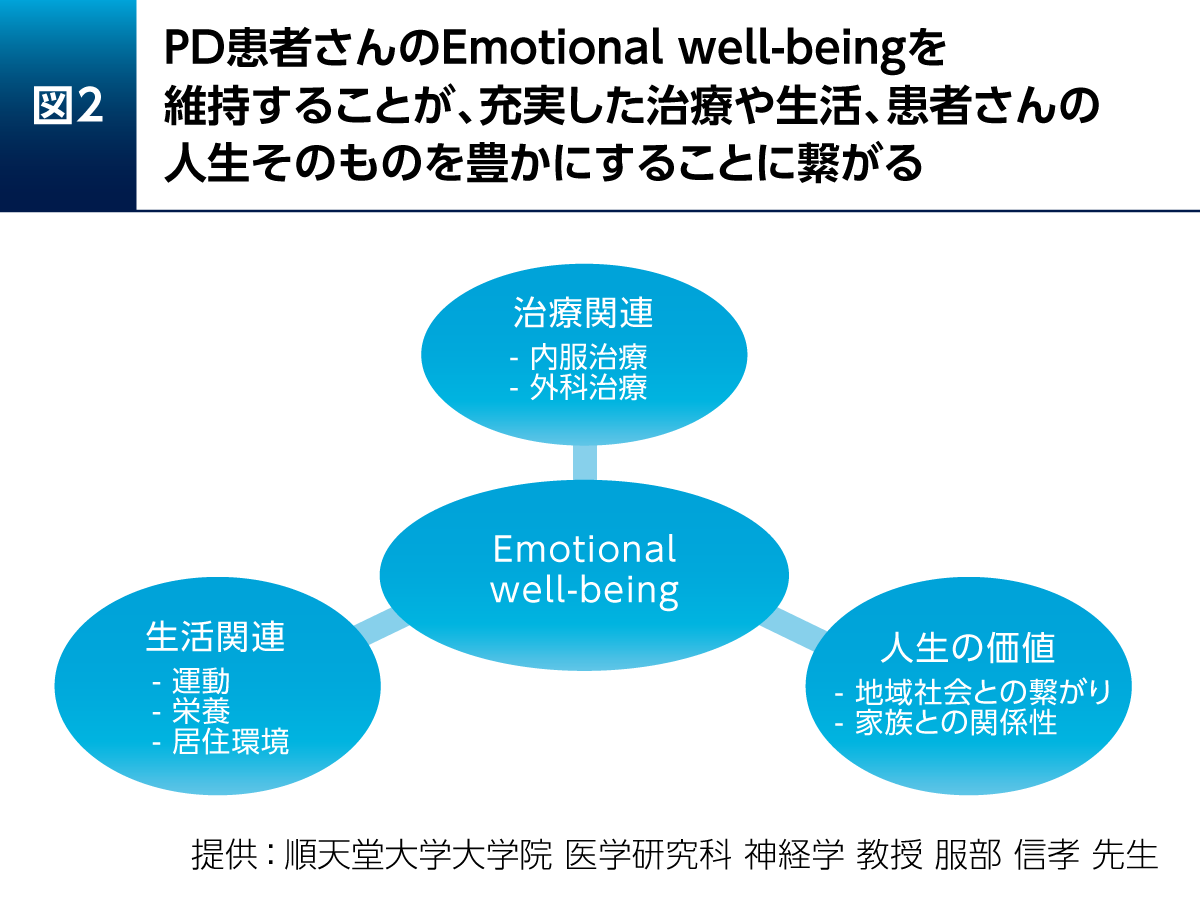
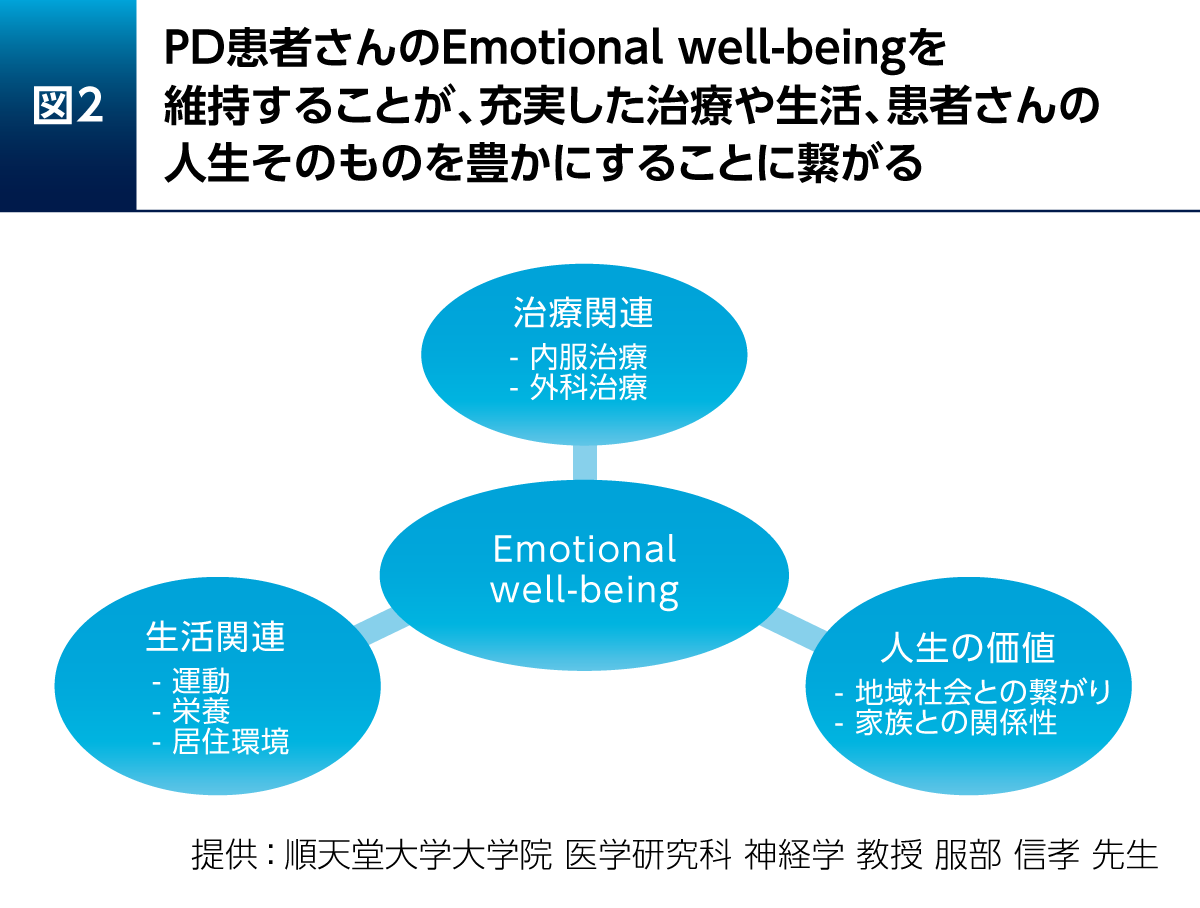
PD患者さんのEmotional well-beingを維持することが充実した治療や生活、人生の豊かさにつながる。そのためには内服薬・外科手術などの治療の要素と運動・栄養・居住環境などの生活関連の要素に加え、講演2で渡辺先生がお話しになったように、地域社会との繋がりや家族との関係性が重要となる。運動については講演1で市川先生がお話しになったように、早期から運動療法を実施することがPD患者さんに大きな影響をもたらすため、その支援も必要である(図2)。
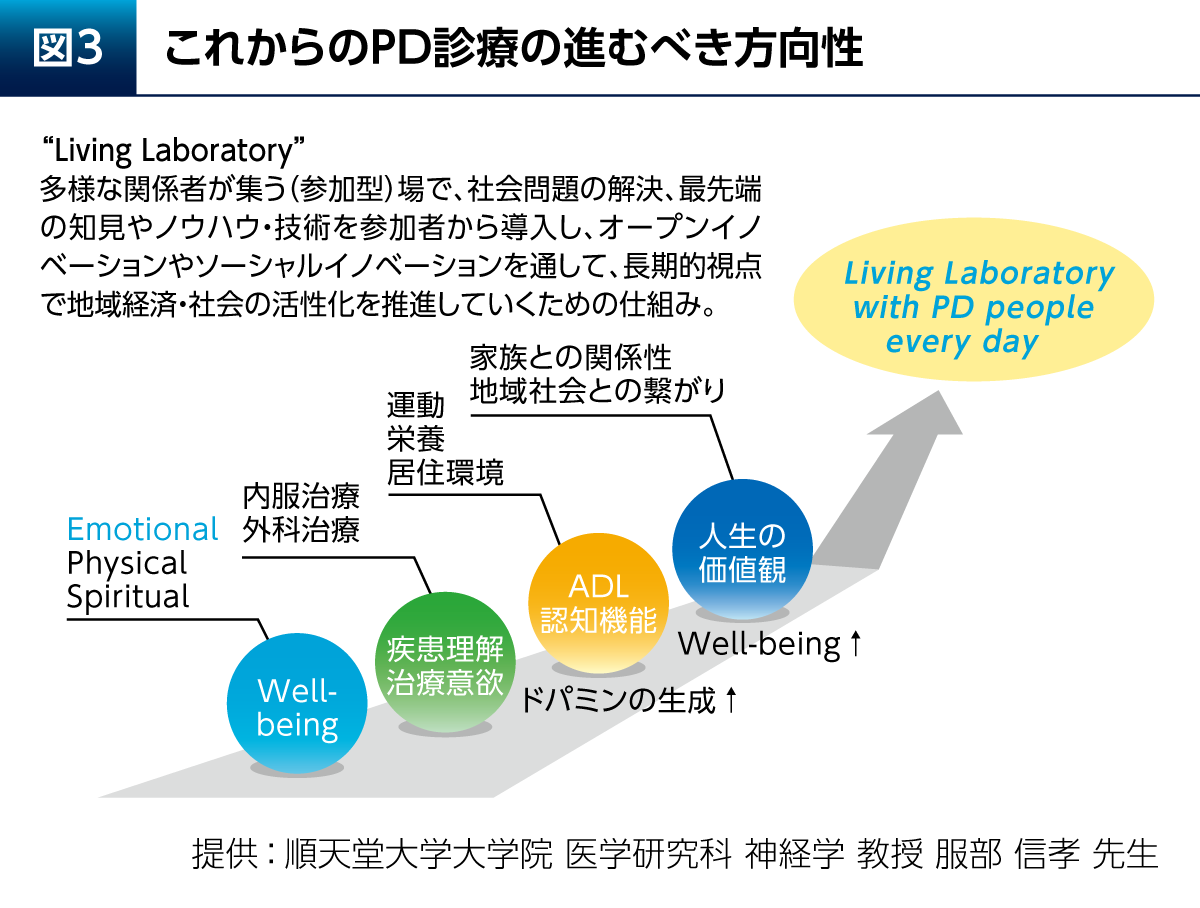
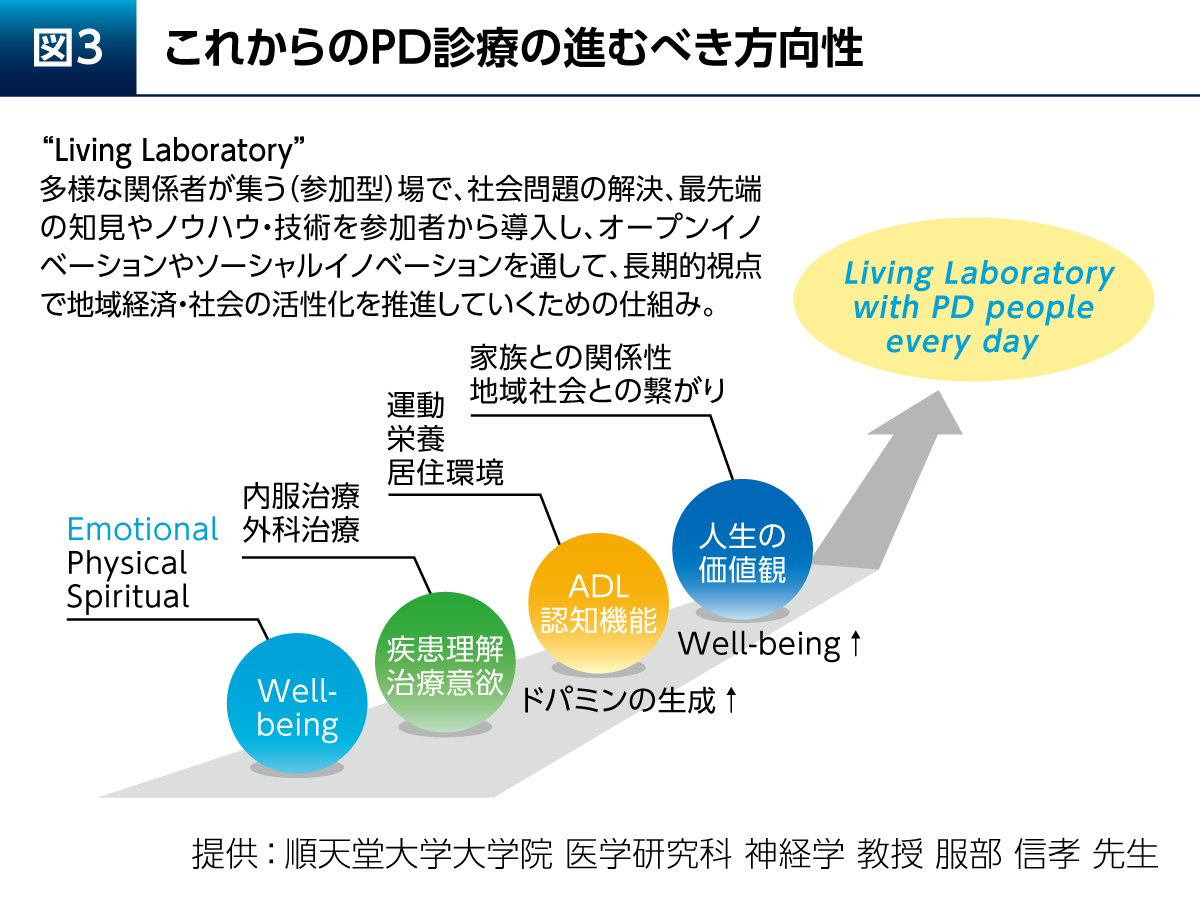
これからのPD診療の進むべき方向性として、Living Laboratoryという考え方が参考になる(図3)。これは患者さんたちを中心として多様な関係者が集うことで、長期的視点でイノベーションを生み出すというものである。多くのスタッフがフラットにPD患者さんに関わる「へテラルキー型」の医療体制を実現し、その先にある“Living Laboratory with PD people”を目指していきたい。
参考文献
1)Bhidayasiri R, et al. J Mov Disord. 2020; 13(2): 105-114.