ファイバ静注用1000 発売中
後天性血友病Aにおける各種薬剤の有用性(海外データ)
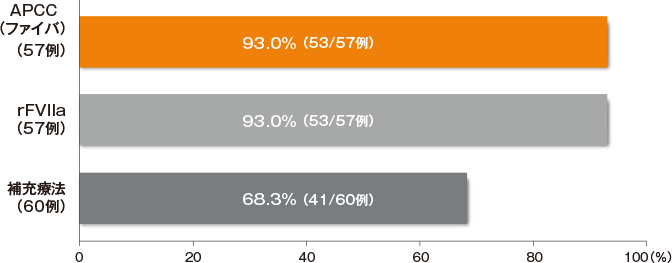
●主要評価項目 後天性血友病A患者に対する最初の出血症状のコントロール率(傾向スコアマッチング解析集団)
- ファイバの最初の出血症状のコントロール率*は93.0%(53/57例)であった。
*出血症状のコントロールの判定基準:治療に対する臨床反応は施設ごとに治験担当医師が判断し、
その反応は「出血消失」(消失日)又は「出血継続」のいずれかで記録した。
●安全性
- 止血治療に関連した血栓塞栓性事象が出血エピソードを経験した482例中13例(止血治療あり307例中11例、なし144例中2例)に認められた。そのうち、止血治療に関係のあった事象は心筋梗塞6例、脳卒中1例、静脈血栓塞栓症4例であった。また、APCC治療群における血栓塞栓性事象の発現は、63例中3例(4.8%)であった。
- 観察期間6年において、治療を受けた患者の全死亡率は19.5%(338例中66例)であった。APCC治療患者では63例中12例(19.0%)が死亡し、1年生存率81%、2~4年の生存率は各76%であった。
- 1回以上の出血エピソードを経験した患者全体で482例中16例、及び止血治療を受けた307例中10例が出血によって死亡した(死亡率3.3%)。治療初日に16例中4例が死亡し、治療から死亡までの期間の中央値は23日であった。
- 最初の出血エピソードにおける止血治療後に死亡した患者のうち、APCC治療群3例では死亡前日数の中央値は16日(1、16、163日)であった。また、最初の出血エピソードの治療に対するanamnestic response(既往免疫反応)は、APCC治療群では63例中6例(9.5%)であった。
- インヒビターの発現については記録されなかった。また、アナフィラキシーあるいはアレルギー反応の発現は報告されなかった。
APCC:activated prothrombin complex concentrate(活性型プロトロンビン複合体製剤)
※全体の副作用発現例数(%)、重篤な副作用、投与中止に至った副作用については論文に記載がなかった。
【対象】
ヨーロッパの13ヵ国の117施設で2003年1月から2008年12月までの期間にweb登録された後天性血友病A患者501症例
【方法】
上記症例を対象に、前方視的に後天性血友病Aの出血症状のコントロールを評価する。
【投与量】
rFVIIaは90μg/kg、APCCは66.67U/kg、FVIIIは52.91U/kg、DDAVPは0.3μg/kgの投与量(中央値)にて治療を開始した。
【評価項目】
主要評価項目:登録患者のバイパス止血製剤(rFVlla又はAPCC) 、FVIII、又はDDAVPで治療した最初の出血症状のコントロール率
安全性(血栓塞栓性事象、死亡率、既往免疫反応、インヒビター・アナフィラキシー・アレルギー反応の発現の有無)
【解析計画】
事前マッチングにはχ2検定、 Mann-Whitney U検定を用い、傾向の推定にはロジスティック回帰分析を用いた。
【Limitation】
試験参加国の人口当たりの推定患者数から考えると登録患者が少なかった。また、登録患者の治療管理は施設ごとに行っており統一されていなかった。
Republished with permission of American Society of Hematology, from Management of bleeding in acquired hemophilia A:
results from the European Acquired Haemophilia (EACH2) Registry.,Baudo F, et al. Blood 2012; 120(1): 39-46. copyright;
permission conveyed through Copyright Clearance Center, Inc.
(著者のうち5名がバクスター[現 武田薬品]のコンサルタントをしており、同社から報酬を受け取っている)
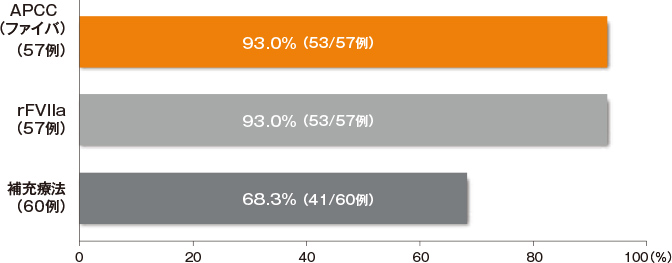
●主要評価項目 後天性血友病A患者に対する最初の出血症状のコントロール率(傾向スコアマッチング解析集団)
- ファイバの最初の出血症状のコントロール率*は93.0%(53/57例)であった。
*出血症状のコントロールの判定基準:治療に対する臨床反応は施設ごとに治験担当医師が判断し、
その反応は「出血消失」(消失日)又は「出血継続」のいずれかで記録した。
●安全性
- 止血治療に関連した血栓塞栓性事象が出血エピソードを経験した482例中13例(止血治療あり307例中11例、なし144例中2例)に認められた。そのうち、止血治療に関係のあった事象は心筋梗塞6例、脳卒中1例、静脈血栓塞栓症4例であった。また、APCC治療群における血栓塞栓性事象の発現は、63例中3例(4.8%)であった。
- 観察期間6年において、治療を受けた患者の全死亡率は19.5%(338例中66例)であった。APCC治療患者では63例中12例(19.0%)が死亡し、1年生存率81%、2~4年の生存率は各76%であった。
- 1回以上の出血エピソードを経験した患者全体で482例中16例、及び止血治療を受けた307例中10例が出血によって死亡した(死亡率3.3%)。治療初日に16例中4例が死亡し、治療から死亡までの期間の中央値は23日であった。
- 最初の出血エピソードにおける止血治療後に死亡した患者のうち、APCC治療群3例では死亡前日数の中央値は16日(1、16、163日)であった。また、最初の出血エピソードの治療に対するanamnestic response(既往免疫反応)は、APCC治療群では63例中6例(9.5%)であった。
- インヒビターの発現については記録されなかった。また、アナフィラキシーあるいはアレルギー反応の発現は報告されなかった。
APCC:activated prothrombin complex concentrate(活性型プロトロンビン複合体製剤)
※全体の副作用発現例数(%)、重篤な副作用、投与中止に至った副作用については論文に記載がなかった。
【対象】
ヨーロッパの13ヵ国の117施設で2003年1月から2008年12月までの期間にweb登録された後天性血友病A患者501症例
【方法】
上記症例を対象に、前方視的に後天性血友病Aの出血症状のコントロールを評価する。
【投与量】
rFVIIaは90μg/kg、APCCは66.67U/kg、FVIIIは52.91U/kg、DDAVPは0.3μg/kgの投与量(中央値)にて治療を開始した。
【評価項目】
主要評価項目:登録患者のバイパス止血製剤(rFVlla又はAPCC) 、FVIII、又はDDAVPで治療した最初の出血症状のコントロール率
安全性(血栓塞栓性事象、死亡率、既往免疫反応、インヒビター・アナフィラキシー・アレルギー反応の発現の有無)
【解析計画】
事前マッチングにはχ2検定、 Mann-Whitney U検定を用い、傾向の推定にはロジスティック回帰分析を用いた。
【Limitation】
試験参加国の人口当たりの推定患者数から考えると登録患者が少なかった。また、登録患者の治療管理は施設ごとに行っており統一されていなかった。
Republished with permission of American Society of Hematology, from Management of bleeding in acquired hemophilia A:
results from the European Acquired Haemophilia (EACH2) Registry.,Baudo F, et al. Blood 2012; 120(1): 39-46. copyright;
permission conveyed through Copyright Clearance Center, Inc.
(著者のうち5名がバクスター[現 武田薬品]のコンサルタントをしており、同社から報酬を受け取っている)
ファイバ 電子添文
1. 警告
エミシズマブ(遺伝子組換え) の臨床試験で、本剤との併用において重篤な血栓塞栓症及び血栓性微小血管症の発現が複数例に認められている。 エミシズマブ(遺伝子組換え) 投与中及び投与中止後6ヵ月間は、治療上やむを得ない場合を除き、本剤の投与を避けること。 血栓塞栓症及び血栓性微小血管症のリスクを増大させる可能性がある。 [8.6、10.2参照]
11.1 重大な副作用
11.1.1 ショック・アナフィラキシー (いずれも頻度不明) [8.8参照]
12. 臨床検査結果に及ぼす影響
12.3 本剤は第VIIIあるいは第IX因子インヒビター患者への投与後に既往性反応が起こることがある。