基本情報
|
2025年11月26日 |
|
| タケキャブ錠・タケキャブOD錠・ボノサップパック・ボノピオンパック・キャブピリン配合錠の「使用上の注意」改訂のお知らせ | |
|
2024年09月12日 |
|
| タケキャブ錠、タケキャブOD錠、ボノサップパック、ボノピオンパック 電子化された添文改訂のお知らせ | |
|
2024年05月27日 |
|
| 患者さん向け服薬注意書「ボノピオンパックの服用方法」RMP マークの誤記に関して |
肝機能障害のある患者さんに対しては、タケキャブの代謝、排泄が遅延することや、フラジール(一般名:メトロニダゾール)の血中濃度が上昇し作用が増強する恐れがあることを考慮し、慎重投与の対象です。
肝機能障害時(肝硬変)におけるヘリコバクター・ピロリの除菌のための薬物投与量について記載された具体的な情報はありません。
(参考資料)
- ボノピオンパック 電子添文
一般的に高齢者では肝機能および腎機能などの生理機能が低下していることが多く、薬剤を投与した際に血中濃度が上昇し、副作用が発現しやすくなる可能性が考えられます。
次の点に注意し、患者さんの状態を観察しながら慎重に投与をお願いします。
特定の背景を有する患者に関する注意1)
9.8 高齢者
一般に、肝機能、腎機能等の生理機能が低下している。アモキシシリン水和物による副作用が発現しやすく、クラリスロマイシンの高い血中濃度が持続するおそれがある。またアモキシシリン水和物によるビタミンK欠乏による出血傾向があらわれることがある。
参考)
ビタミンKは食事からの摂取量に加え、腸内細菌により産生されますが、抗菌薬の投与により腸内細菌によるビタミンK産生量が低下することが知られている。
高齢者では、腸管からのビタミンK吸収量が低下すると考えられており、注意が必要である2)。
(参考資料)
- ボノピオンパック 電子添文
- 日本人の食事摂取基準(2020年版)「日本人の食事摂取基準」策定検討会報告書
https://www.mhlw.go.jp/content/10904750/000586553.pdf(閲覧日:2023年9月23日)
妊娠3ヵ月以内の女性(有益性が危険性を上回ると判断される疾患の場合は除く)への投与は禁忌です。
妊娠3ヵ月を過ぎた女性への投与は、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。
<参考>
■ボノプラザンフマル酸塩
動物試験(ラット)において、40mg/日でのヒトにおけるボノプラザンの曝露量(AUC)の約28倍を超える曝露量で、胎児体重及び胎盤重量の低値、外表異常(肛門狭窄及び尾の異常)、並びに内臓異常(膜性部心室中隔欠損及び鎖骨下動脈起始異常)が認められています。
■メトロニダゾール
[外国人データ] 分娩開始初期からメトロニダゾール内服錠200mgを3時間ごとに投与して、母子各24例の血中濃度を測定した。新生児の血中濃度の平均値は0.9μg/mLであり、胎盤関門を通過して胎児に移行することが認められています。
(参考資料)
ボノピオンパック インタビューフォーム
電子添文上、服用タイミング、間隔について特に規定はありません。用法及び用量は1日2回のみの記載となっています1)。
患者さんのコンプライアンスのよい時に、朝・夕での服用をご指導ください。
ただし、抗生物質、特にアモキシシリンは時間依存性の抗生物質なので、12時間ごとの服用をお勧めします。
なお、ボノプラザンの体内動態に及ぼす食事の影響は、絶食下投与と比較して食後投与でAUC0-48及びCmaxはやや増加する傾向が見られたものの、その程度は小さかったです2)。
(参考資料)
- ボノピオンパック 電子添文
- ボノピオンパック インタビューフォーム
ボノプラザンは主として肝薬物代謝酵素CYP3A4で代謝され、一部CYP2B6、CYP2C19およびCYP2D6で代謝されます。
また、ボノプラザンの胃酸分泌抑制作用により、併用薬剤の吸収を促進または抑制する可能性があります。
<併用禁忌>
ボノプラザンの併用禁忌に準じて設定しています。
アモキシシリン水和物、メトロニダゾールで併用禁忌に該当する医薬品はありません。
詳細は電子添文の相互作用の項をご確認ください。
<併用注意>
ボノプラザン、アモキシシリン水和物、メトロニダゾールの併用注意に準じて設定しています。
詳細は電子添文の相互作用の項をご確認ください。
■ボノプラザンの併用注意薬剤名等
CYP3A4阻害剤(クラリスロマイシン等)、ジゴキシン、メチルジゴキシン、イトラコナゾール、チロシンキナーゼ阻害剤(ゲフィチニブ、ニロチニブ、エルロチニブ)、ネルフィナビルメシル酸塩、CYP3A4で代謝される薬剤(ミタゾラム等)
■アモキシシリン水和物の併用注意薬剤名等
ワルファリンカリウム、経口避妊薬、プロベネシド
■メトロニダゾールの併用注意薬剤名等
アルコール、リトナビル含有製剤(内用液)、ジスルフィラム、ワルファリン、リチウム、ブスルファン、5-フルオロウラシル、シクロスポリン、フェノバルビタール
(参考資料)
- ボノピオンパック 電子添文
ボノピオンパック400・800の電子添文に
「投与しないこと。アモキシシリン水和物の血中濃度が上昇することがあり、本製品では各製剤の投与量を調節できない。」と記載があります。
(参考資料)
- ボノピオンパック 電子添文
メトロニダゾール(フラジール内服錠)の電子添文に基づき設定しています。
参考)
■メトロニダゾール
[外国人データ]
分娩開始初期からメトロニダゾール内服錠200mgを3時間ごとに投与して、母子各24例の血中濃度を測定した。新生児の血中濃度の平均値は0.9μg/mLであり、胎盤関門を通過して胎児に移行することが認められています。
(参考資料)
- ボノピオンパック インタビューフォーム
メトロニダゾール(フラジール内服錠)の電子添文に基づき設定しています1)。
参考)2)
2012年8月の効能・効果等の追加承認(脳膿瘍)に伴い、脳、脊髄に器質的疾患のある患者に関しては海外添付文書(米、英、独、仏)では禁忌に設定されていないものの、国内外の副作用報告には脳、脊髄に器質的疾患のある患者での重篤な中枢神経系副作用の集積もあり、死亡例や後遺症の残る症例も認められていることから、脳、脊髄に器質的疾患のある患者のうち脳膿瘍の患者を除き、引き続き禁忌として注意を喚起した。なお、追加承認された脳膿瘍は、死亡や神経学的後遺症を生じるおそれのある重篤な疾患であり、本剤による治療の必要性が高いと考えられることから、中枢神経障害の発現に注意した上で本剤投与が可能となるよう、脳膿瘍の患者を「Ⅷ. 6. 特定の背景を有する患者に関する注意」の項に設定した。また、中枢神経障害に関する注意喚起を強化するために、「Ⅴ. 4. 用法及び用量に関連する注意」及び「Ⅷ. 8. (1)重大な副作用と初期症状」の項に中枢神経障害に関する注意を追記した。
(参考資料)
- ボノピオンパック インタビューフォーム
- フラジール インタビューフォーム
現時点で電子添文記載にいたるまでの情報が集積されていません1)。
なお、開発時の臨床試験では報告はありませんでした2)。
(参考資料)
- タケキャブ錠/OD錠 10mg・20mg 電子添文
- タケキャブ錠/OD錠 10mg・20mg インタビューフォーム
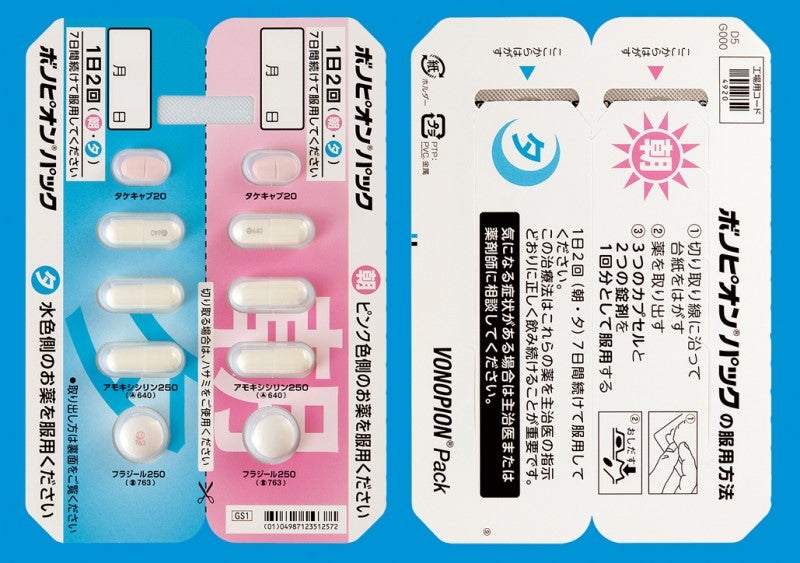
ボノピオンパックの各錠剤の重さ・大きさは下記のとおりです。
| 錠剤名 | タケキャブ錠 20mg | アモキシシリンカプセル250mg | メトロニダゾール250mg |
| 長径(mm) | 11.2 | 18.8 | ― |
| 短径(mm) | 6.2 | 6.3 | ― |
| 直径(mm) | ― | ― | 約10.8 |
| 厚さ(mm) | 約3.9 | ― | 約6.0 |
| 質量(mg) | 約229 | 377 | 約600 |
参考)
ボノピオンパックは以下の3製剤を組み合わせたものです。
| 1シート(1日分)中 | タケキャブ錠 20mg アモキシシリンカプセル 250mg フラジール内服錠 250mg | 2錠 6カプセル 2錠 |
ボノピオンパックの形状(PTP包装1シート)

(参考資料)
- ボノピオンパック インタビューフォーム
ボノピオンパック製剤は、そのまま処方していただくための製剤です。
脱カプセルが必要な場合は、それぞれの薬剤のカプセル以外の剤形を単剤で処方いただくことをお勧めします。
(参考資料)
- ボノピオンパック 電子添文
ボノピオンパックは「パック製剤」のため粉砕投与を想定していません。
粉砕での使用は承認外の用法であり、粉砕したものをヒトに投与した際の有効性・安全性については検討していません。
(参考資料)
- ボノピオンパック 電子添文
- ボノピオンパック インタビューフォーム
ボノピオンパックは「パック製剤」のため分包または一包化は想定していません。
(参考資料)
- ボノピオンパック 電子添文
- ボノピオンパック インタビューフォーム
タケキャブ20mg、アモキシシリンカプセル250mg及びメトロニダゾール錠250mgの3剤を組み合わせたものです。
■タケキャブ(一般名:ボノプラザンフマル酸塩)
主に肝薬物代謝酵素CYP3A4で代謝され、一部CYP2B6、CYP2C19及びCYP2D6で代謝されます[in vitro]。また、硫酸転移酵素SULT2A1でも代謝されます[in vitro]。
■アモキシシリン水和物
penicilloic acidに代謝され、さらにpenamaldic acidに代謝されます。
■メトロニダゾール
肝臓で、主代謝物であるヒドロキシメトロニダゾールへの代謝にはCYP2A6が関与しています[in vitro]。
(参考資料)
- ボノピオンパック インタビューフォーム
■タケキャブ(一般名:ボノプラザンフマル酸塩)
[外国人データ]
尿及び糞便中に排泄されます。
■アモキシシリン水和物
主に尿中に排泄されるが、一部胆汁中にも排泄されます。
■メトロニダゾール
主に腎臓から排泄されます。
(参考資料)
- ボノピオンパック インタビューフォーム
アモキシシリン水和物については、武田テバ薬品に製造委託しています。メトロニダゾールは塩野義製薬のフラジール内服錠です。
(参考資料)
- ボノピオンパック 電子添文
電子添文上、当該薬との併用に関して注意喚起はしておりません。
タケキャブと他の防御因子増強剤を併用した場合の影響について弊社で検討した成績はありません。
なお、保険請求の可否については、請求先の審査機関でご確認ください。
(参考資料)
- タケキャブ錠/OD錠 10mg・20mg 電⼦添⽂
除菌治療の時期については、患者さんの状態に合わせて選択してください。
参考)
「除菌治療の時期は症例に応じて考慮すべきで、一般に重症例については抗潰瘍治療をまずおこない、軽症例では除菌治療からおこなってもよいことが多い。」と記載されている報告があります。
(参考資料)
- Helicobacter Research 23(2)p.181-183 2019
飲み忘れが除菌率に与える影響について検討したデータはありません。
参考)
PPIを使用した1次除菌療法において、5日間と7日間投与の比較では5日間投与の除菌率は有意に低かったことが報告されています。
(参考資料)
- Scand J Gastroenterol. 2001 Jun; 36(6): 584-8.
様々な国の報告のメタ解析の結果として、再感染率は年率3.1%であったことが報告されています1)。
また日本における再感染率については、年率2%以下と報告されています2)。
(参考資料)
- Aliment Pharmacol Ther+D8. 2017 Nov;46(9):773-779.
- 消化性潰瘍診療ガイドライン2020改訂第3版:日本消化器病学会編集、南江堂、p.56
二次除菌療法の間は、アルコールの接種(飲酒)を避けてください。
メトロニダゾールがアルデヒド脱水素酵素を阻害し、血中アセトアルデヒド濃度を上昇させ、アンタビュース様作用(顔面紅潮、悪心・嘔吐、血管性頭痛等の急性アルコール中毒症状)が発現する可能性があります。
一般的に、除菌率に飲酒は関係しないと考えられていますが、アルコールは、急性胃潰瘍の重要な病因の1つですので、適度な飲酒に留めた方がよいと考えます1)。
(参考資料)
- EBMに基づく胃潰瘍診療ガイドラインQ&A:胃潰瘍ガイドラインの適用と評価に関する研究班編集、平成20年5月15日、じほう社
各ボタンはくすりの適正使用協議会サイトにリンクします。
日本語版
英語版
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。