製品・疾患紹介動画
製品に関するWeb講演会
製品に関するWeb講演会
短腸症候群全国Webセミナー
短腸症候群 全国webセミナー
短腸症候群全国Webセミナー
短腸症候群 全国Webセミナー
中等度以上の腎機能障害(クレアチニンクリアランス50mL/min未満)患者さんでは、本剤の血中濃度が上昇することから、1回あたりの投与量は0.025mg/kgとしてください。
中等度以上の腎機能障害(クレアチニンクリアランス50mL/min未満)患者さんでは、
・体重20kg未満の場合、レベスティブ皮下注用0.95mg
・体重20kg以上40kg以下の場合、レベスティブ皮下注用0.95mg 又は 3.8mg
・体重40kg超の場合、レベスティブ皮下注用3.8mg
を投与してください。
(腎機能障害患者さんを対象とした薬物動態試験:外国人データ)
中等度並びに重度腎機能障害及び末期腎不全の患者にテデュグルチド10mgを単回皮下投与した時の血漿中テデュグルチド濃度のAUC0–inf及びCmaxは、腎機能障害の重症度が高いほど高値となり、中等度腎機能障害及び末期腎不全の患者では腎機能正常者と比較してAUC0–infがそれぞれ1.5倍及び2.6倍、Cmaxがそれぞれ1.6倍及び2.1倍でした。
また、母集団薬物動態解析の結果、軽度腎機能障害の日本人患者でのCL/F及びVc/Fの平均値は腎機能正常の日本人患者での値との差が10%以内でしたが、中等度腎機能障害の日本人患者では腎機能正常の日本人患者と比較してCL/F及びVc/Fがそれぞれ37%及び24%低いという結果でした。
※本剤の承認された用法及び用量は、「通常、テデュグルチド(遺伝子組換え)として1日1回0.05mg/kgを皮下注射する。」です。
(参考資料)
レベスティブ皮下注用3.8mg・0.95mg 電子添文
レベスティブ皮下注用3.8mg・0.95mgの電子添文において、肝機能障害患者さんに対する注意事項は設定されていません。
(肝機能障害患者さんを対象とした薬物動態試験:外国人データ)
中等度肝機能障害患者さん(Child-Pugh分類、グレードB)にテデュグルチド20mgを単回皮下投与した時の血漿中テデュグルチド濃度のCmax及びAUCは、中等度の肝障害を有する被験者の方が、肝機能正常者よりも10%~15%低い結果でした。
※本剤の承認された用法及び用量は、「通常、テデュグルチド(遺伝子組換え)として1日1回0.05mg/kgを皮下注射する。」です。
(参考資料)
- レベスティブ皮下注用3.8mg・0.95mg 電子添文
- レベスティブ皮下注用3.8mg・0.95mg インタビューフォーム
注射後に注射部位をもむと腫れることがあるので、もまないでください。
(参考資料)
- レベスティブ自己投与ガイドブック
針を刺した部位での注射はやめて、その部位から少なくとも3cm離れた部位を選び、注射してください。
(参考資料)
- レベスティブ自己投与ガイドブック
注射する時間は何時でも構いませんが、毎日の注射を忘れないようにするために、毎回同じ時間に注射するよう患者さんにご指導ください。
(参考資料)
- レベスティブ自己投与ガイドブック
投与を忘れた場合には、気づいた時点で直ちに投与してください。ただし、1日に2回の投与は行わないでください。
(参考資料)
- レベスティブ皮下注用3.8mg・0.95mg 電子添文
本剤は1回使用の製剤のため、再使用しないでください。
(参考資料)
- レベスティブ皮下注用3.8mg・0.95mg 電子添文
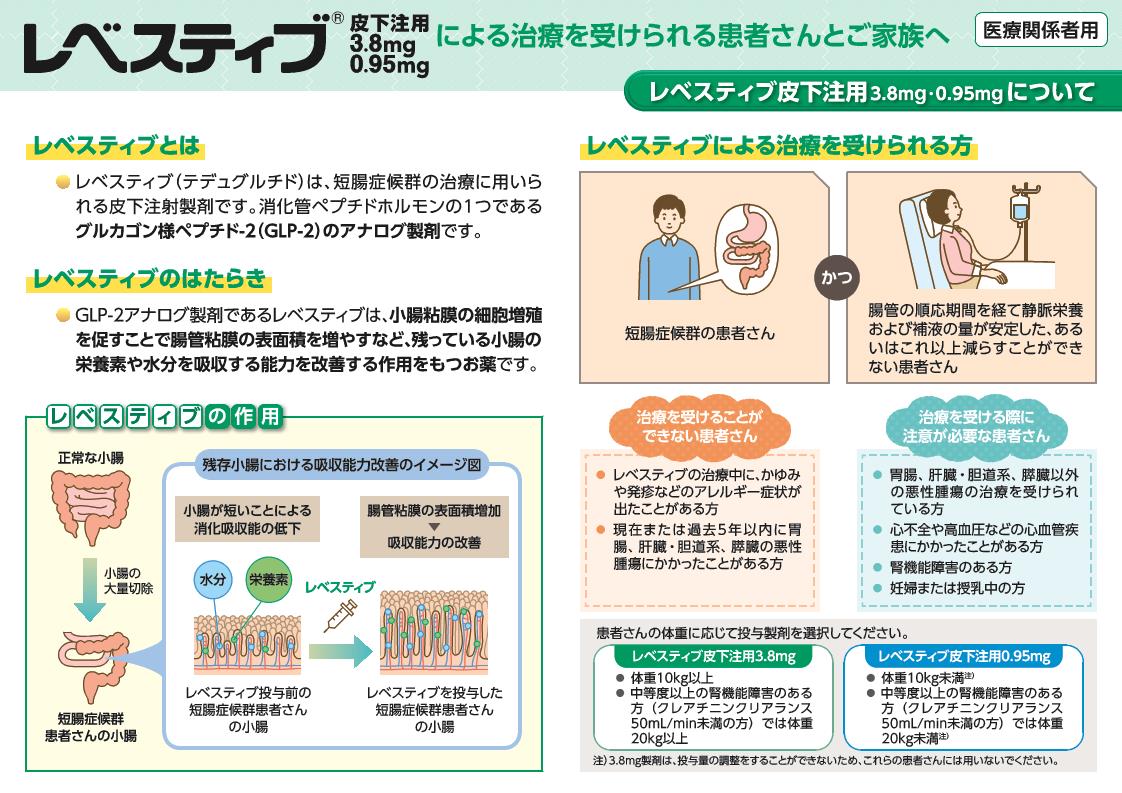
患者さんの体重に応じて、投与製剤を選択してください。
3.8mg製剤と0.95mg製剤との生物学的同等性試験は実施していないため、互換使用を行わないでください。
・体重10kg未満の場合、レベスティブ皮下注用0.95mg
・体重10kg以上20kg以下の場合、レベスティブ皮下注用0.95mg 又は 3.8mg
・体重20kg超の場合、レベスティブ皮下注用3.8mg
を投与してください。
中等度以上の腎機能障害(クレアチニンクリアランス50mL/min未満)患者さんでは、
・体重20kg未満の場合、レベスティブ皮下注用0.95mg
・体重20kg以上40kg以下の場合、レベスティブ皮下注用0.95mg 又は 3.8mg
・体重40kg超の場合、レベスティブ皮下注用3.8mg
を投与してください。
なお、修正月齢4ヵ月未満の患者さんを対象とした臨床試験は実施しておらず、投与は推奨しておりません。
(参考資料)
レベスティブ皮下注用3.8mg・0.95mg 電子添文
【レベスティブ皮下注用3.8mg製剤】
投与量(mL)=体重(kg)×0.05(mg/kg)/ 10(mg/mL)
【レベスティブ皮下注用0.95mg製剤】
投与量(mL)=体重(kg)×0.05(mg/kg)/ 2.5(mg/mL)
(参考資料)
- レベスティブ皮下注用を投与する際の注意事項
あらかじめ氷などで注射部位を冷やしておくと痛みが少なくなるといわれています。また、一般的に皮下脂肪の多い部位に注射したほうが痛みが少ないと感じる方が多いようです。
(参考資料)
- レベスティブ自己投与ガイドブック
入浴は可能ですが、注射直後の入浴は避けてください。また、体を洗うときなどに注射部位を強くこすらないようにしてください。
(参考資料)
- レベスティブ自己投与ガイドブック
薬剤が溶けていない場合はバイアルをもう一度約15秒間転がし、約2分間待ちます。
薬液に濁り、微粒子または沈殿が認められる場合は、そのバイアルは使用せず、新しいバイアルを用意して最初からもう一度やり直してください。
(参考資料)
- レベスティブ自己投与ガイドブック
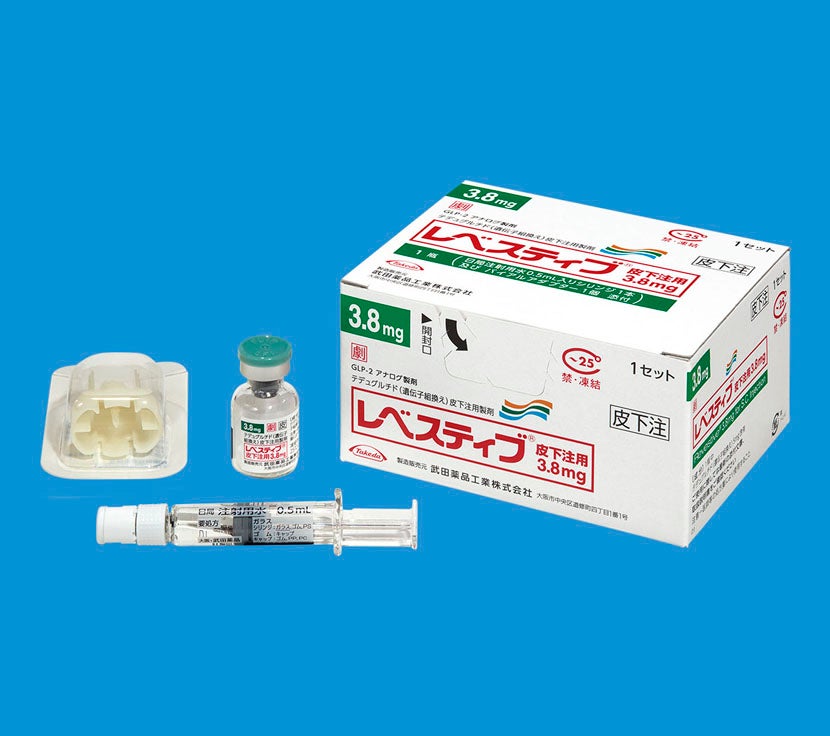
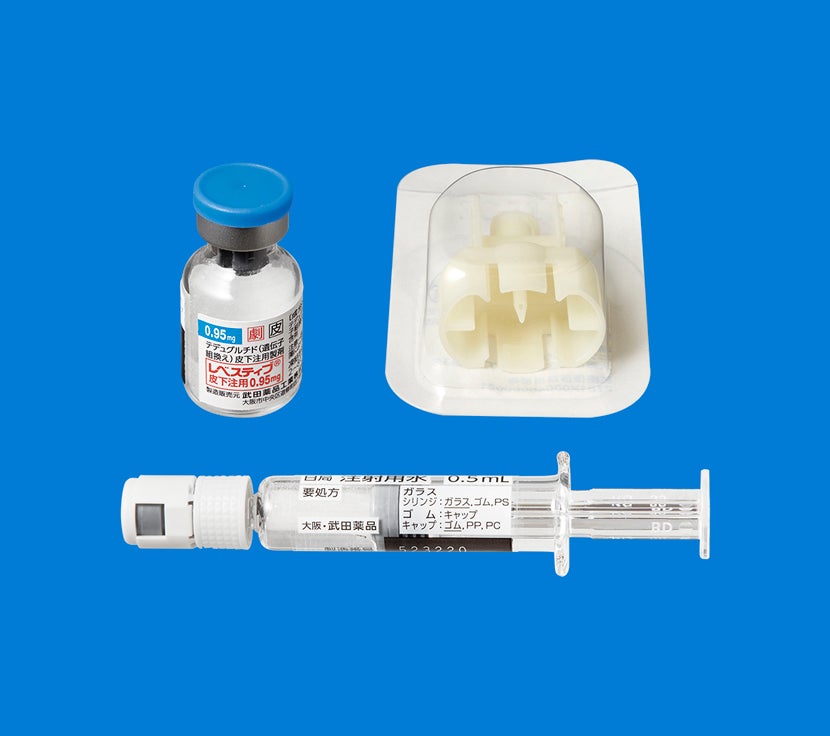
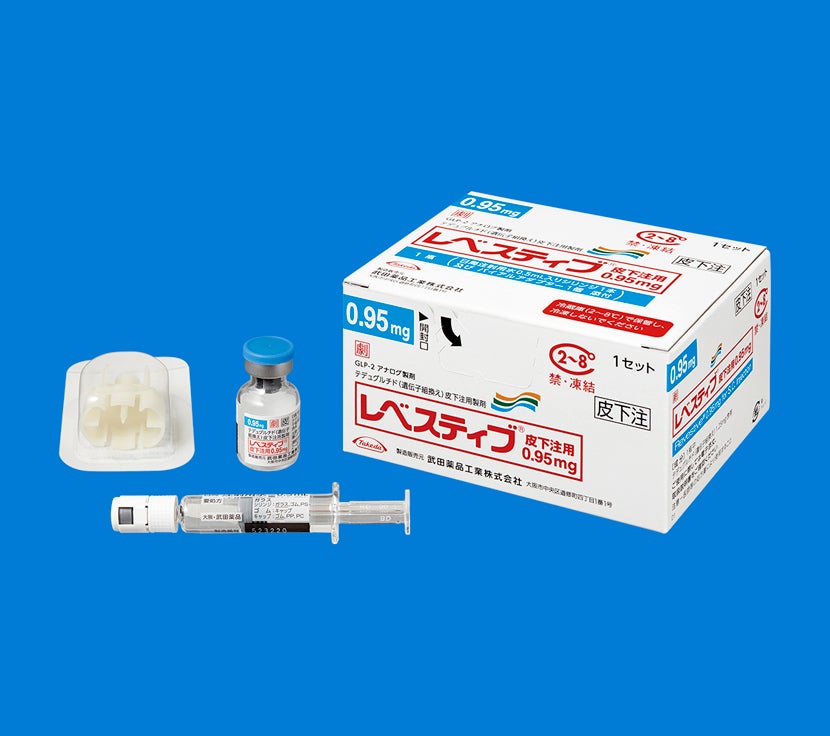
包装箱には、薬剤バイアル(レベスティブ)、バイアルアダプター、日局注射用水0.5mL入りシリンジが添付されています。
注射用シリンジ、注射針、綿球またはガーゼ、消毒用アルコール綿、ばんそうこう、廃棄容器は別途ご用意いただきますようお願いいたします。
(参考資料)
- レベスティブ皮下注用3.8mg・0.95mg 電子添文
- レベスティブ自己投与ガイドブック
調製後は速やかに投与してください。本剤は保存剤を含有していないため、調製後は3時間以内に使用してください。
また、未使用分は廃棄してください。
(参考資料)
- レベスティブ皮下注用3.8mg・0.95mg 電子添文
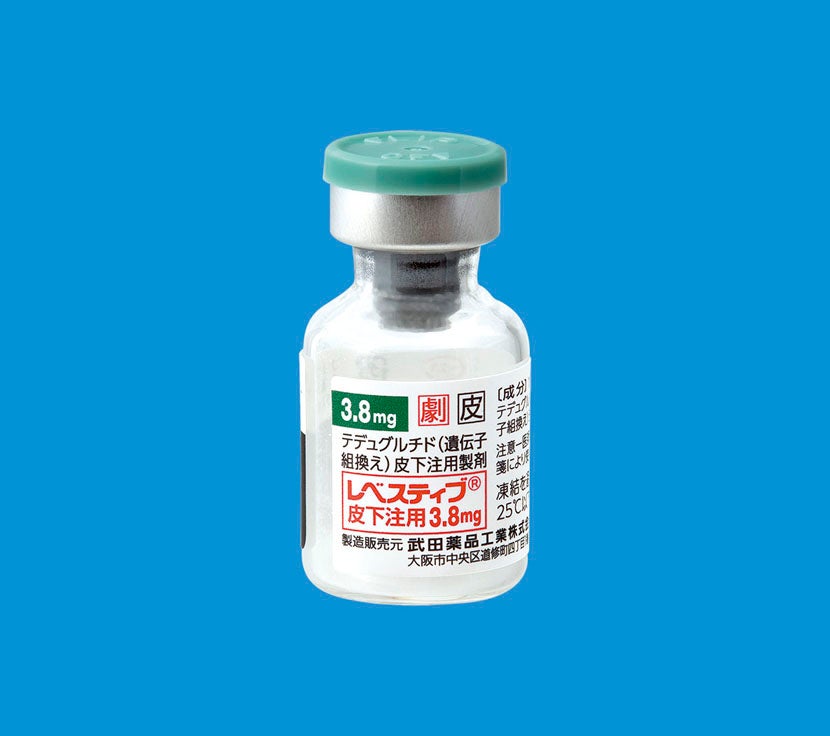
【レベスティブ皮下注用3.8mg製剤】
調製した薬液の吸引時及び投与時の損失を考慮し、1バイアルから3.8mgを注射するに足る量を確保するため5mg充填されており、添付溶解液0.5mLで溶解した時に10mg/mLとなります。
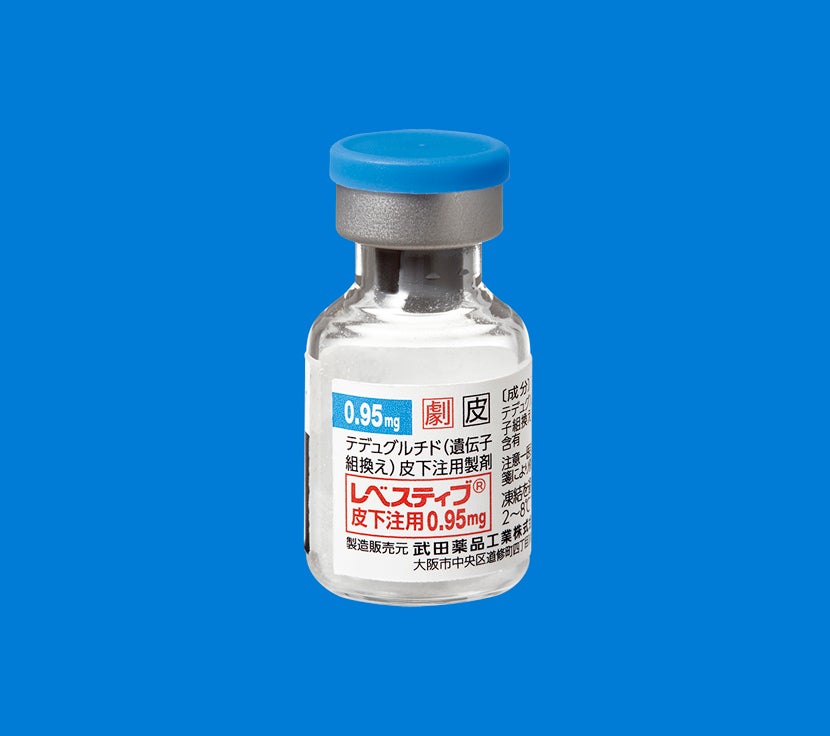
【レベスティブ皮下注用0.95mg製剤】
調製した薬液の吸引時及び投与時の損失を考慮し、1バイアルから0.95mgを注射するに足る量を確保するため1.25mg充填されており、添付溶解液0.5mLで溶解した時に2.5mg/mLとなります。
(参考資料)
- レベスティブ皮下注用3.8mg・0.95mg 電子添文
本剤は皮下注射のため、栄養剤などの輸液に混ぜないでください。
(参考資料)
- レベスティブ自己投与ガイドブック
同じ注射用シリンジと針を使用してください。
1本目のバイアル内の薬液を吸引した注射用シリンジに、2本目のバイアル内の薬液を吸引してください。
(参考資料)
- レベスティブ自己投与ガイドブック
使用済みの針と注射用シリンジは、破損しにくく密閉できる容器に入れ、医療機関に持参してください。家庭の一般ごみとして廃棄しないでください。また、針刺し事故防止のため、針のキャップは取り付けないでください。
その他の注射器具については、医療機関や各自治体のルールに従って、一般ごみとして廃棄してください。
(参考資料)
- レベスティブ自己投与ガイドブック
各ボタンはくすりの適正使用協議会サイトにリンクします。
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。