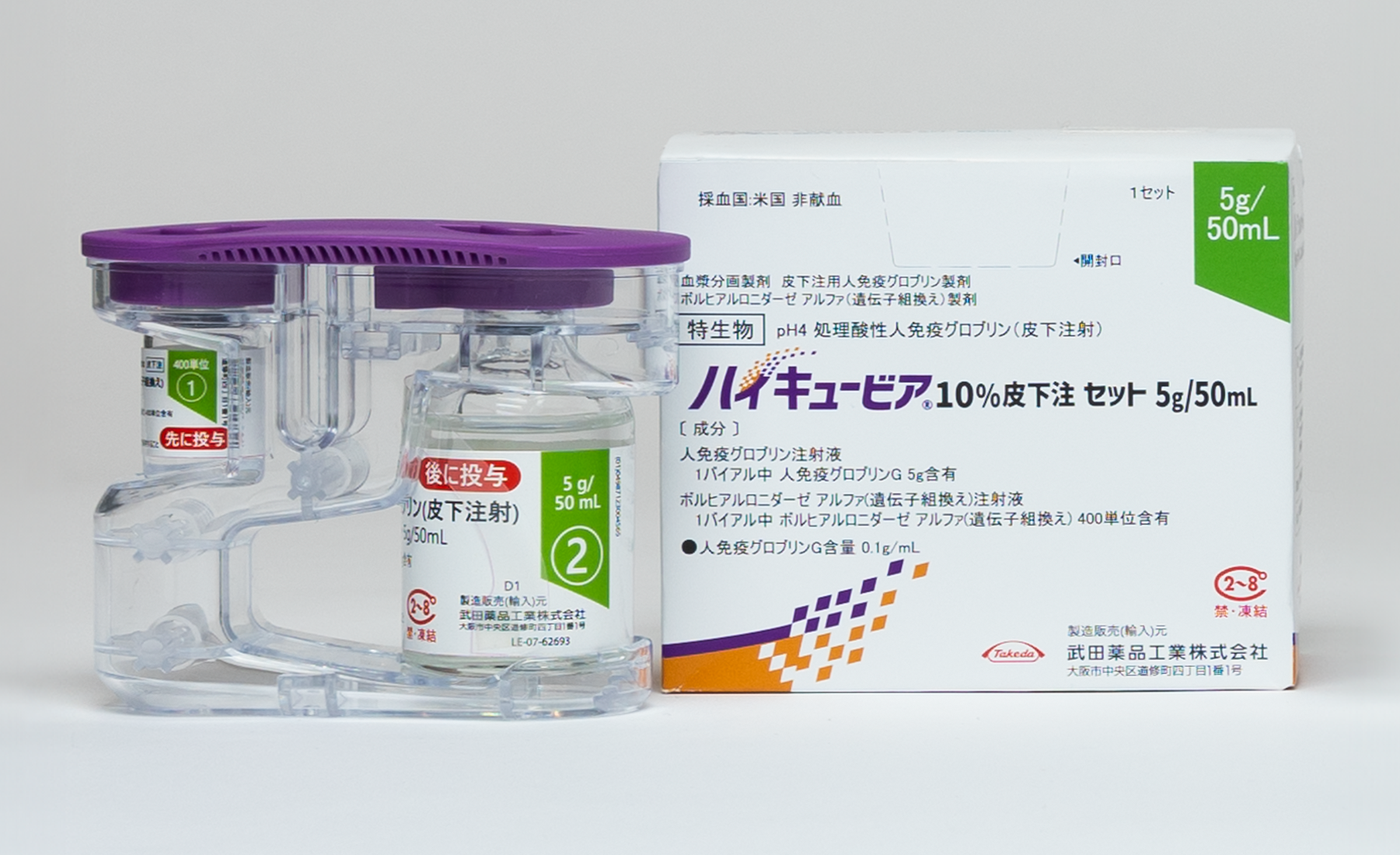
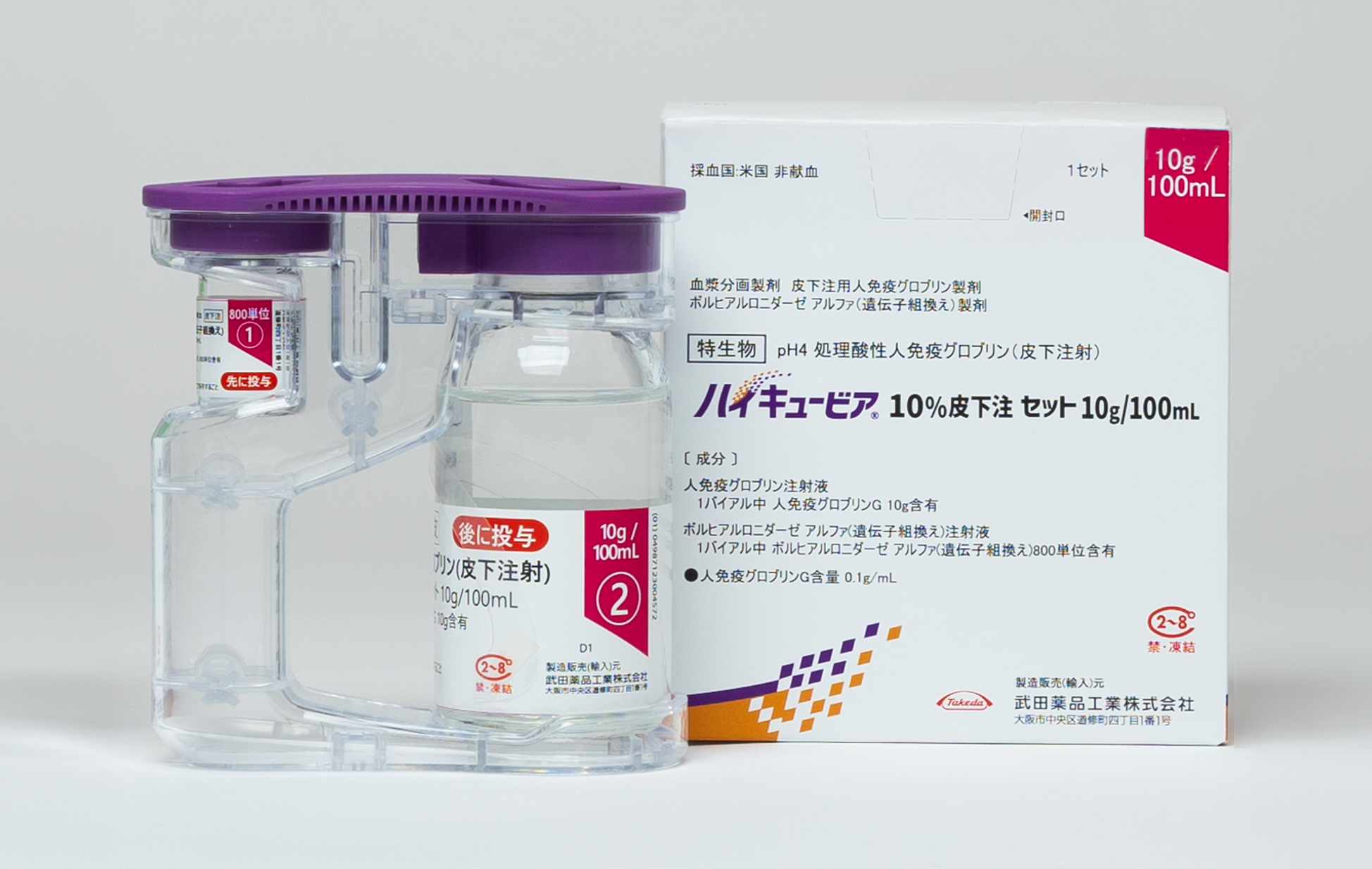
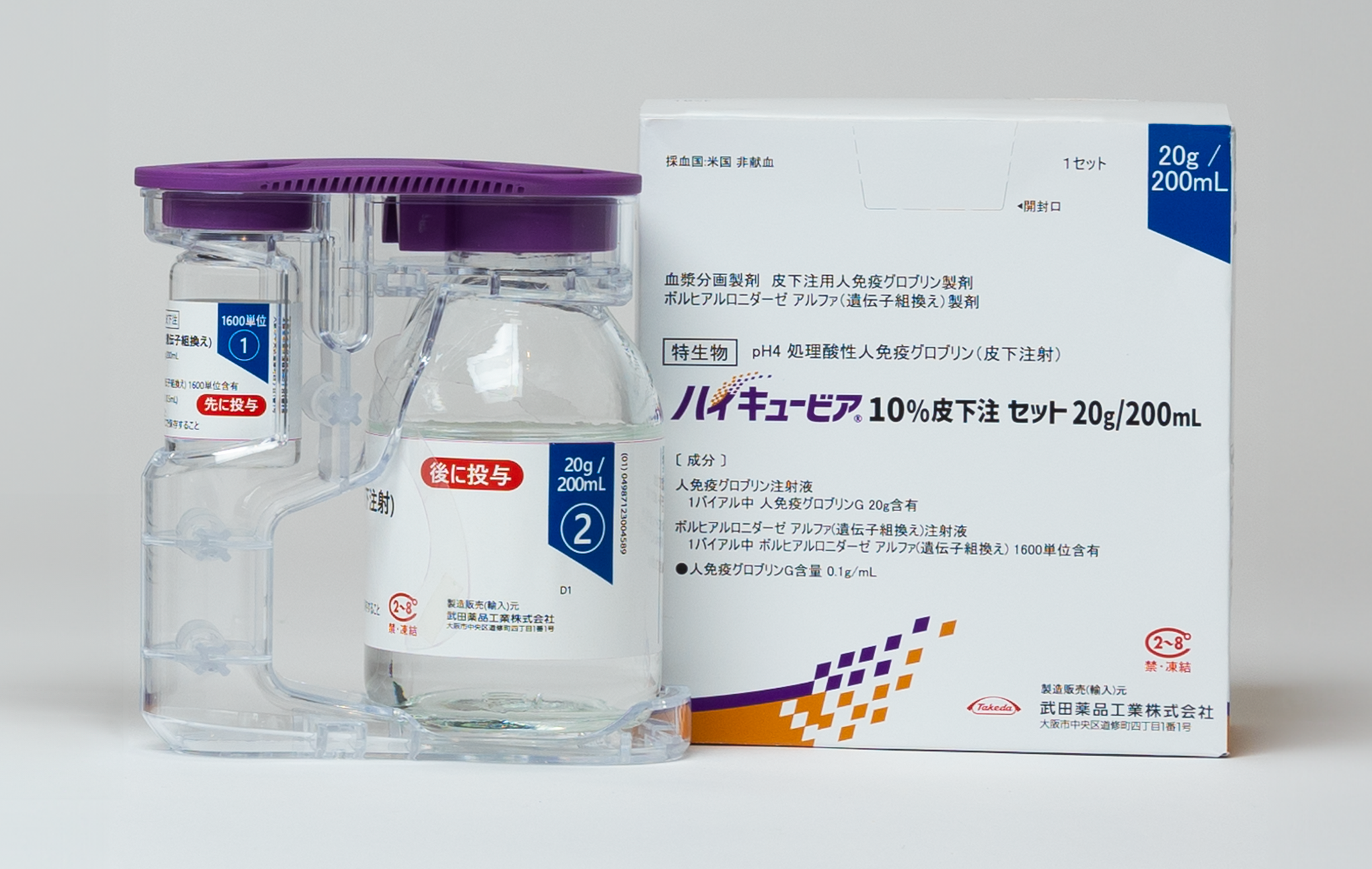
基本情報
|
2025年11月01日 |
|
| ハイキュービア10%皮下注セット限定出荷に関するお知らせ | |
|
2025年06月24日 |
|
| ハイキュービア皮下注セット「使用上の注意」改訂のお知らせ | |
|
2025年06月24日 |
|
| ハイキュービア10%皮下注セット「効能又は効果」「用法及び用量」追加承認取得のご案内 |
製品・疾患紹介動画
ハイキュービア は、感染症から体を守る免疫グロブリン (Ig) 抗体を含む液剤の薬で、以下の効能又は効果を有しています。
〇無又は低ガンマグロブリン血症
〇慢性炎症性脱髄性多発根神経炎及び多巣性ニューロパチーの運動機能低下の進行抑制(筋力低下の改善が認められた場合)
ハイキュービアは、人免疫グロブリンとボルヒアルロニダーゼ アルファの組み合わせ医薬品です。
ボルヒアルロニダーゼ アルファは結合組織におけるヒアルロン酸の脱重合を介する(加水分解)ことにより、皮下組織における浸透性を増加させることで、IgGの拡散吸収を促進します。
(低出生体重児、新生児、乳児及び2歳未満の幼児を対象とした臨床試験は実施していません)
参考資料:電子添文、総合製品情報概要
ボルヒアルロニダーゼ アルファ注射液 および 人免疫グロブリン注射液輸液は、輸液ポンプ等を用いて投与してください。
ボルヒアルロニダーゼ アルファ注射液については手動でも投与可能です。
(電子添文の記載)
14.2 薬剤投与時の注意
14.2.1 ボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液については、輸液ポンプ等又は手動にて投与すること。
14.2.2 人免疫グロブリン注射液については、投与速度の調節可能な輸液ポンプ等を用いて投与すること。
参考資料:電子添文
光の影響を防ぐために、薬剤バイアルは外箱に入れた状態で、凍結を避け2~8℃で保存してください。
冷蔵庫で保存する場合には、使用前に室温に戻し、室温に戻した後は、再び冷蔵庫に戻さず、3カ月以内に使用してください。
参考資料:電子添文
「本剤の成分に対しショックの既往歴のある患者」が禁忌対象です。
本剤の成分に対しショックの既往歴のある患者に本剤を投与した場合、ショック等の重篤な過敏性反応が誘発されるおそれがあるので、本剤の成分に対しショックの既往歴のある患者への本剤の投与は避けてください。
参考資料:電子添文
本剤には供血者由来の各種抗体(各種感染症の病原体又はその産生物質に対する免疫抗体、自己抗体等)が含まれており、投与後の血中にこれらの免疫抗体が一時検出されることがあるので、臨床診断には注意を要します。また、供血者由来の赤血球型抗原に対する抗体(抗A、抗B及び抗D抗体)により、赤血球型同種抗体の血清学的検査(クームス試験)に干渉することがあります。
また、製造工程にウイルス除去膜等からβ‐D‐グルカンが溶出する工程が含まれているため、製剤中にも微量含まれます。製剤の投与量に比例してβ‐D‐グルカン値が上昇し、大量投与で検出される可能性があります。
参考資料:電子添文
非経口用生ワクチン〔麻疹ワクチン、おたふくかぜワクチン、風疹ワクチン、これら混合ワクチン、水痘ワクチン等〕:
本剤の投与を受けた者は、生ワクチンの効果が得られないおそれがあるので、生ワクチンの接種は本剤投与後3 ヵ月以上延期してください。
また、生ワクチン接種後14 日以内に本剤を投与した場合は、投与後3 ヵ月以上経過した後に生ワクチンを再接種することが望ましいとされています。
なお、慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーに対する大量療法(200mg/kg体重以上)後に生ワクチンを接種する場合は、原則として生ワクチンの接種を6ヵ月以上(麻疹感染の危険性が低い場合の麻疹ワクチン接種は11ヵ月以上)延期してください。
参考資料:電子添文
必ずボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液から先に注入してください。
ボルヒアルロニダーゼ アルファ(遺伝子組換え)投与後、約10分以内に同じ部位へ人免疫グロブリン注射液を皮下投与してください。
ボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液と人免疫グロブリン注射液を混合しないでください。
ボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液については、輸液ポンプ等又は手動にて投与してください。
人免疫グロブリン注射液については、投与速度の調節可能な輸液ポンプ等を用いて投与してください。
本剤は腹部中央から上腹部及び大腿部等に皮下投与してください。
2ヵ所又 は3ヵ所から投与する場合、各注入部位は腹部中央から上腹部の反対側で10cm以上の間隔をあけるか、反対側の大腿部としてください。
骨の隆起、瘢痕、炎症又は感染のある部位は避けてください。
投与部位は3ヵ所までとし、1日あたりの人免疫グロブリン注射液の投与部位あたりの最大投与容量は、体重40㎏未満で、投与部位数が 1~2か所の場合は 300mL/部位、3か所の場合は 200mL/部位です。
体重40㎏以上で、投与部位数が 1~2か所の場合は 600mL/部位、3か所の場合は 400mL/部位です。
参考資料:電子添文
本剤は調製不要の液剤です。希釈せずに投与してください。
参考資料:電子添文
(1)ボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液の投与速度は、投与部位あたり1~2mL/分、又は忍容性に応じて調整してください。
人免疫グロブリン注射液は、ボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液の注入終了後約10分以内に同じ翼状針投与セットから投与してください。
(2)人免疫グロブリン注射液の投与部位あたりの投与速度は、最初の2回は体重40㎏未満の患者の場合5mL/時間、体重40㎏以上の患者では10mL/時間から開始し、5~15分ごとに漸増し、最大で体重40㎏未満の患者では80mL/時間まで、体重40㎏以上の患者では240mL/時間まで増加が可能です。その後の投与では、開始時は体重40㎏未満の患者では10mL/時間、体重40㎏以上の患者では10mL/時間とし、最大で体重40㎏未満の患者では160mL/時間まで、体重40㎏以上の患者では300mL/時間まで増加が可能です。
詳細な投与スケジュールについては電子添文をご参照ください。
参考資料:電子添文
他の製剤との混注は避けてください。
また、ボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液と人免疫グロブリン注射液も混合しないでください。
参考資料:電子添文、インタビューフォーム
同意書の取得は必須ではありません。ただし万が一に備えて、同意書を取得いただくことが望ましいと考えられます。
医薬品医療機器法
(特定生物由来製品取扱医療関係者による特定生物由来製品に係る説明)
第六八条の二一
特定生物由来製品を取り扱う医師その他の医療関係者(以下「特定生物由来製品取扱医療関係者」という。)は、特定生物由来製品の有効性及び安全性その他特定生物由来製品の適正な使用のために必要な事項について、当該特定生物由来製品の使用の対象者に対し適切な説明を行い、その理解を得るよう努めなければならない。
参考資料:医薬品医療機器法
未使用の血漿分画製剤は、非感染性廃棄物として取り扱ってください。
【参考:廃棄物処理法に基づく感染性廃棄物処理マニュアル 令和5年5月】
「血液製剤については、それ自体には感染性がないことから感染性廃棄物ではないが、外見上血液と見分けがつかない輸血用血液製剤(全血製剤、血液成分製剤)等は血液等に該当するものとする。」とされています。
参考資料:廃棄物処理法に基づく感染性廃棄物処理マニュアル
投与可能ですが、人免疫グロブリン製剤による治療歴のない患者を対象とした臨床試験は実施されていません。
感染頻度や重症度等本剤による治療の臨床反応と血清IgG濃度を参考に、投与量を慎重に調節してください。
また、漸増後の投与間隔は3週間又は4週間隔に調整してください。
参考資料:電子添文
使用後の残液は、細菌汚染のおそれがあるので再使用しないでください。
参考資料:電子添文
各ボタンはくすりの適正使用協議会サイトにリンクします。
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。