基本情報
製品・疾患紹介動画
製品に関するWeb講演会
製品に関するWeb講演会










承認外の用法であり、懸濁したものをヒトに投与した際の有効性、安全性は確立していませんので、弊社からはお勧めしていません。
ご参考までに、トリンテリックス錠インタビューフォームに記載の「崩壊性及び懸濁液の経管通過性」及び「懸濁液の安定性」をご参照ください1)。
(参考資料)
- トリンテリックス錠10mg・20mg インタビューフォーム
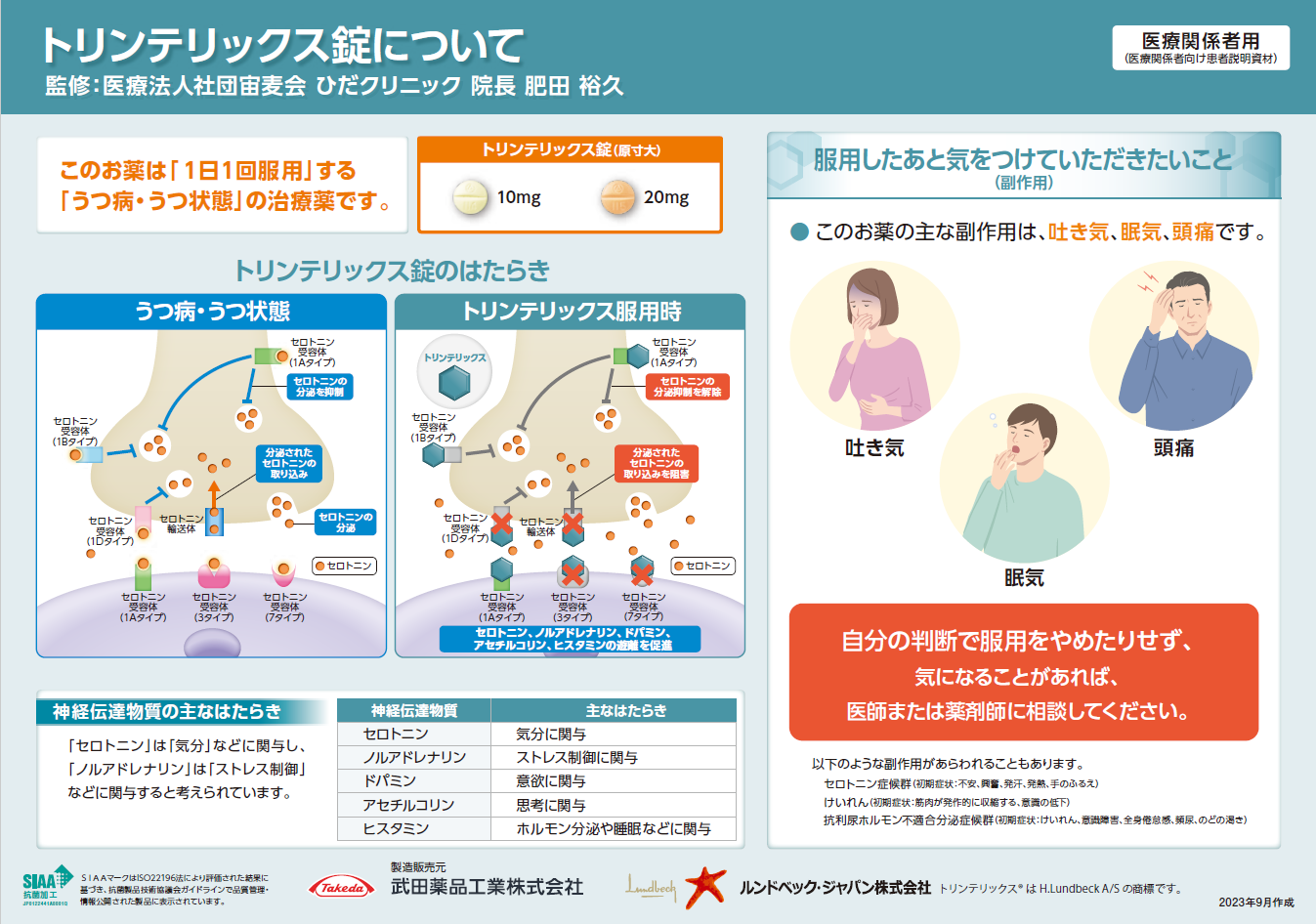
「無包装状態の安定性」をご紹介します。
◇トリンテリックス錠10mg・20mg(共通)
無包装状態で、温度25℃、湿度75%、遮光の条件下で観察した結果、3ヵ月後まで、外観、含量、溶出性などについて特に問題となる変化はありませんでした1)。
(参考資料)
- トリンテリックス錠10mg・20mg インタビューフォーム
◇トリンテリックス錠10mg、20mg
両面割線入りの錠剤であり、半錠にすることは可能です。
↓
(半錠の安定性は?)
分割後、温度25℃、75%RH、白色蛍光灯の条件下で観察した結果、100日後まで、外観、含量、溶出性などについて特に問題となる変化はありませんでした1)。
(参考資料)
- トリンテリックス錠10mg・20mg インタビューフォーム
分包後(単剤での分包、他剤との一包化)の安定性は検討していません。
ご参考までに、「無包装状態の安定性」をご紹介します。
■無包装状態の安定性(製剤単独)
トリンテリックス錠10mg及び20mgを25℃/75%RH、遮光の条件下で保存した場合、いずれも3ヵ月後まで、外観、含量、溶出性などについて特に問題となる変化は認められませんでした。
また、40℃/75%RH、遮光の条件下で保存した場合、いずれも3ヵ月後まで、外観、含量、溶出性などについて特に問題となる変化は認められませんでした1)。
(参考資料)
- トリンテリックス錠10mg・20mg インタビューフォーム
承認外の用法であり、粉砕したものをヒトに投与した際の有効性、安全性は確立していませんので、弊社からはお勧めしていません。
ご参考までに、トリンテリックス錠インタビューフォーム「粉砕後の安定性」をご参照ください1)。
(参考資料)
- トリンテリックス錠10mg・20mg インタビューフォーム
透析等による除去率に関する資料はございません1)。
(参考資料)
トリンテリックス錠10mg・20mg インタビューフォーム
承認外の用法であり、懸濁したものをヒトに投与した際の有効性、安全性は確立していませんので、弊社からはお勧めしていません。
ご参考までに、トリンテリックス錠インタビューフォームに記載の「崩壊性及び懸濁液の経管通過性」及び「懸濁液の安定性」をご参照ください1)。
(参考資料)
トリンテリックス錠10mg・20mg インタビューフォーム
承認外の用法であり、懸濁したものをヒトに投与した際の有効性、安全性は確立していませんので、弊社からはお勧めしていません。
ご参考までに、トリンテリックス錠インタビューフォームに記載の「崩壊性及び懸濁液の経管通過性」及び「懸濁液の安定性」をご参照ください1)。
(参考資料)
- トリンテリックス錠10mg・20mg インタビューフォーム
各ボタンはくすりの適正使用協議会サイトにリンクします。
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。