タクザイロ皮下注300mgシリンジ 発売中
海外第Ⅲ相臨床試験 【海外データ】
「禁忌を含む注意事項等情報」は電子添文をご参照ください。
海外第Ⅲ相多施設共同無作為化二重盲検プラセボ対照比較試験(DX-2930-03試験:検証試験)1-3)
1)社内資料(承認時評価資料):ラナデルマブの遺伝性血管性浮腫患者を対象とした海外第Ⅲ相試験成績
2)Banerji A, et al. JAMA. 2018; 320(20): 2108-2121.
本試験はDyax社(現:Takeda)の資金提供により実施された。
本論文の著者のうち3名はShire社(現:Takeda)の社員である。
著者にDyax社又はShire社(現:Takeda)よりコンサルタント料等を受領している者が含まれる。
3)Lumry WR, et al. Allergy. 2021; 76 (4): 1188-1198.
本試験はShire社(現:Takeda)の資金提供により実施された。本論文の著者のうち3名はTakedaの社員である。
著者に同社よりコンサルタント料等を受領している者が含まれる。
本試験は、一部国内承認外の用法及び用量を含みますが、承認時評価資料のため記載します。また、150mg 4週に1回投与群は、国内承認外の用法及び用量のため、試験結果より削除しました。
試験概要
目的
Ⅰ型又はⅡ型の遺伝性血管性浮腫(HAE)患者を対象として、タクザイロの有効性及び安全性を検討する。
対象
HAE(Ⅰ型又はⅡ型)患者126例
評価項目
主要評価項目:投与期間中(Day 0~182)に治験責任医師が確認したHAE発作発現回数(検証項目)
安全性評価項目:重篤な有害事象及び特に注目すべき有害事象(AESI)を含む全ての有害事象、
治療継続率 等
その他の評価項目:血管性浮腫に伴うQoL(AE-QoL)質問票各スコアの変化量 等
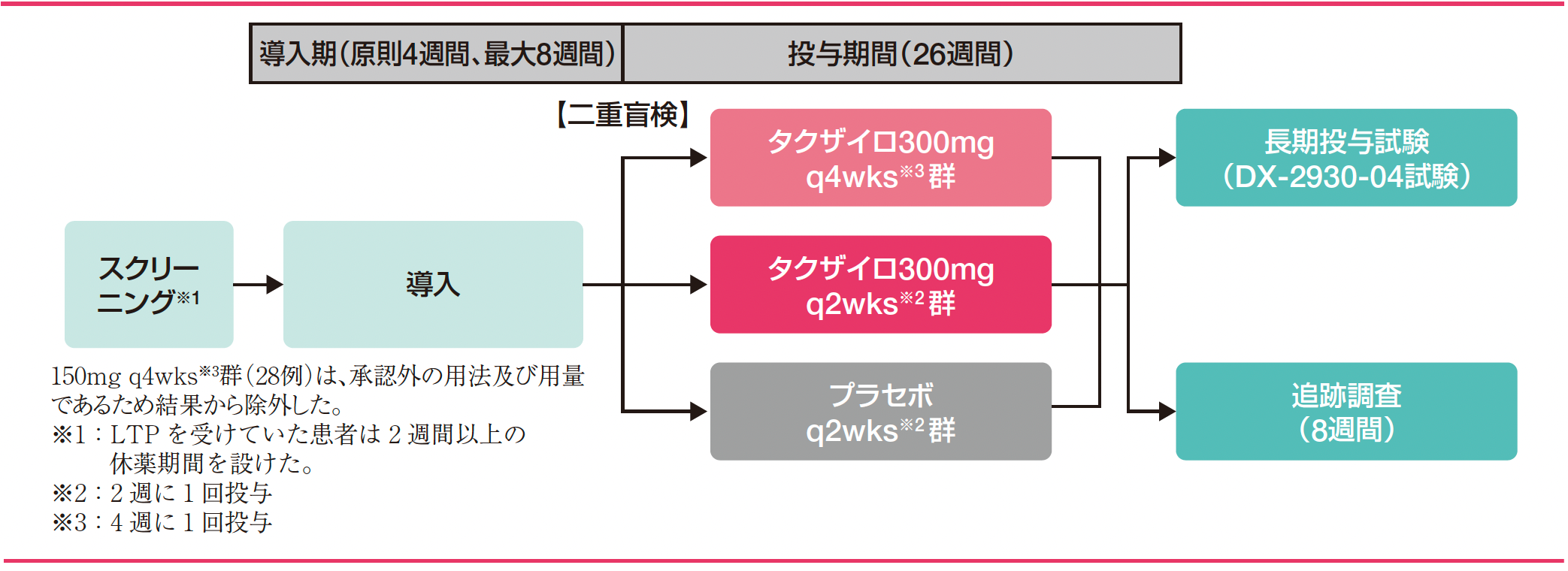
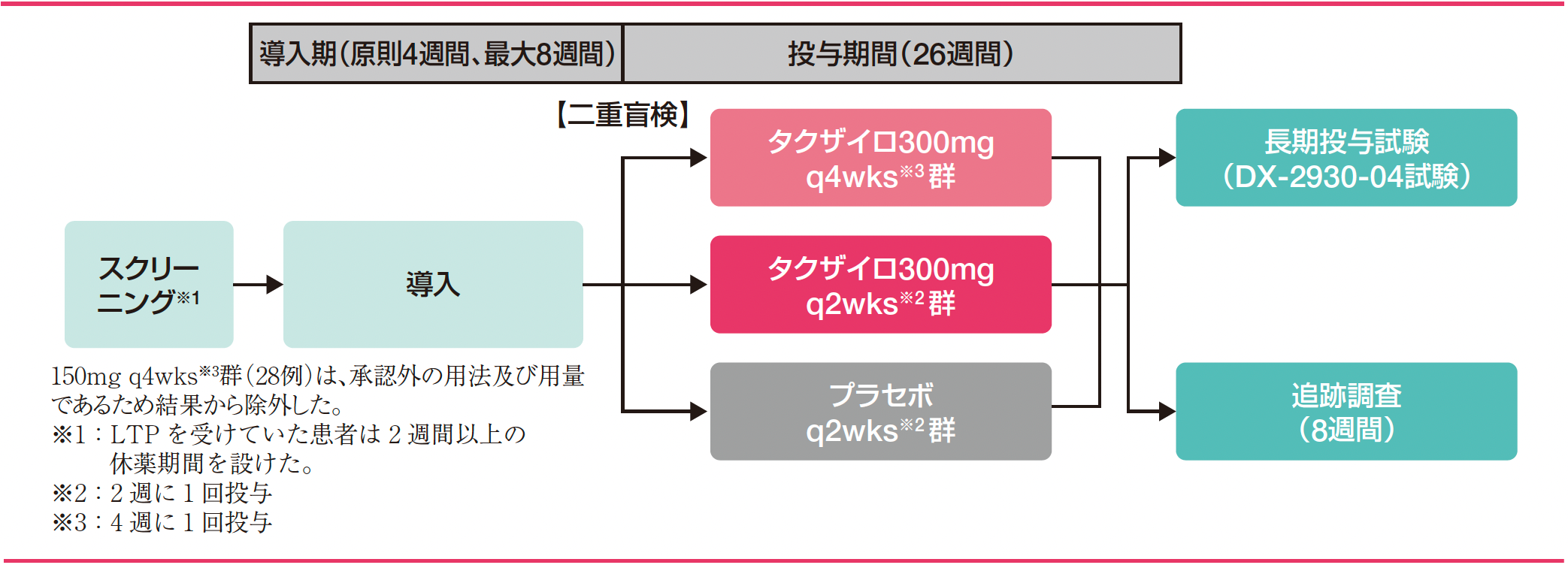
試験デザイン
患者背景
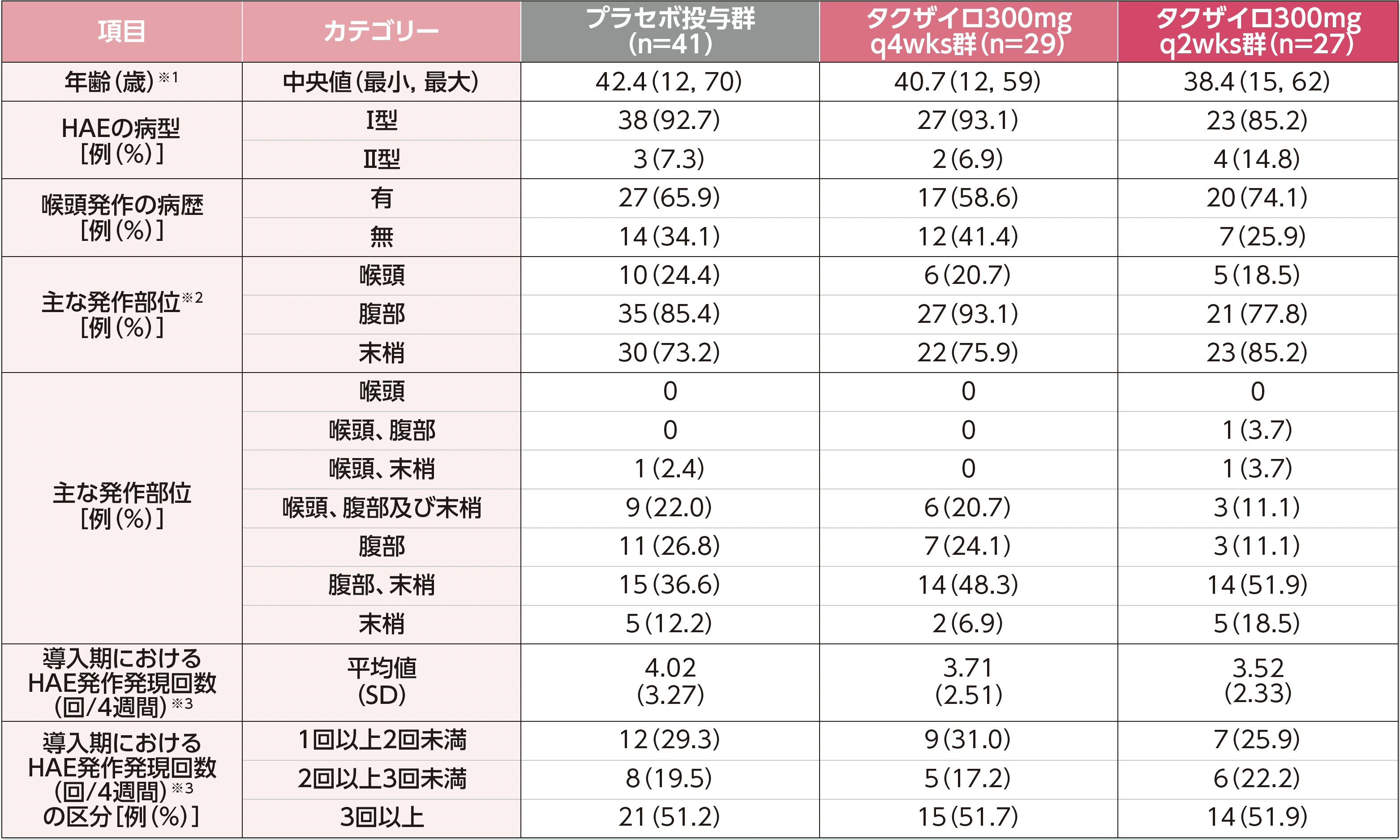
※1:年齢は、生年月日とインフォームドコンセントの日付との差として算出し、年数で切り捨てた。
※2:複数のカテゴリーに重複してカウントした症例を含む。
※3:導入期のHAE発作発現回数は、導入期間中に発生したHAE発作発現回数を導入期の日数で除し、28日を乗じて算出した。
HAE:遺伝性血管性浮腫、q2wks:2週に1回投与、q4wks:4週に1回投与、SD:標準偏差
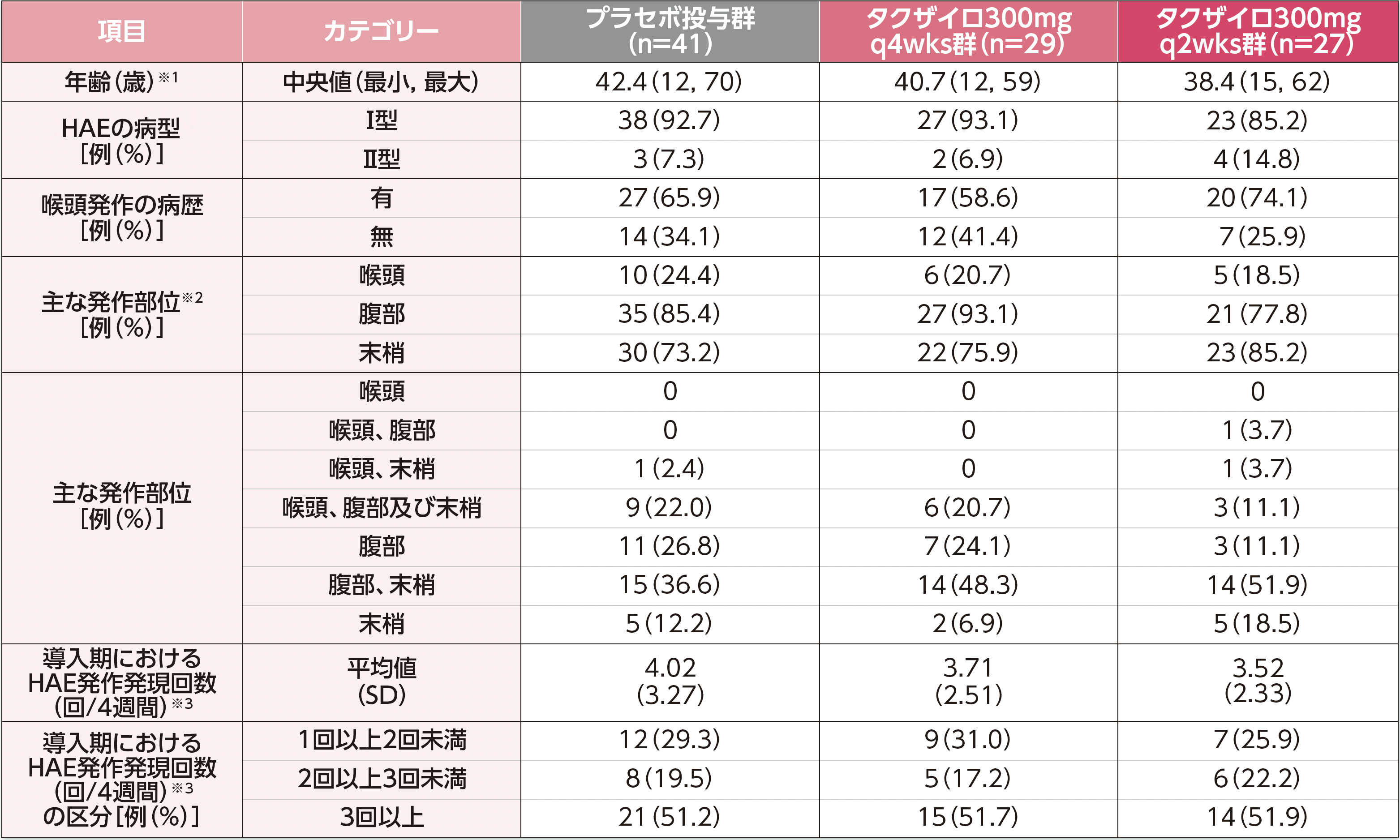
※1:年齢は、生年月日とインフォームドコンセントの日付との差として算出し、年数で切り捨てた。
※2:複数のカテゴリーに重複してカウントした症例を含む。
※3:導入期のHAE発作発現回数は、導入期間中に発生したHAE発作発現回数を導入期の日数で除し、28日を乗じて算出した。
HAE:遺伝性血管性浮腫、q2wks:2週に1回投与、q4wks:4週に1回投与、SD:標準偏差
有効性
1.投与期間中(Day 0~182)に治験責任医師が確認したHAE発作発現回数(主要評価項目:検証項目)
プラセボ投与群との調整済み投与群間差(95%CI)は、タクザイロ300mg q4wks群で−73.27%(−82.38, −59.46)、300mg q2wks群で−86.92%(−92.83, −76.15)であり、いずれも有意な差が検証されました(p<0.001、Poisson回帰モデル、Bonferroni法により多重性を調整)。
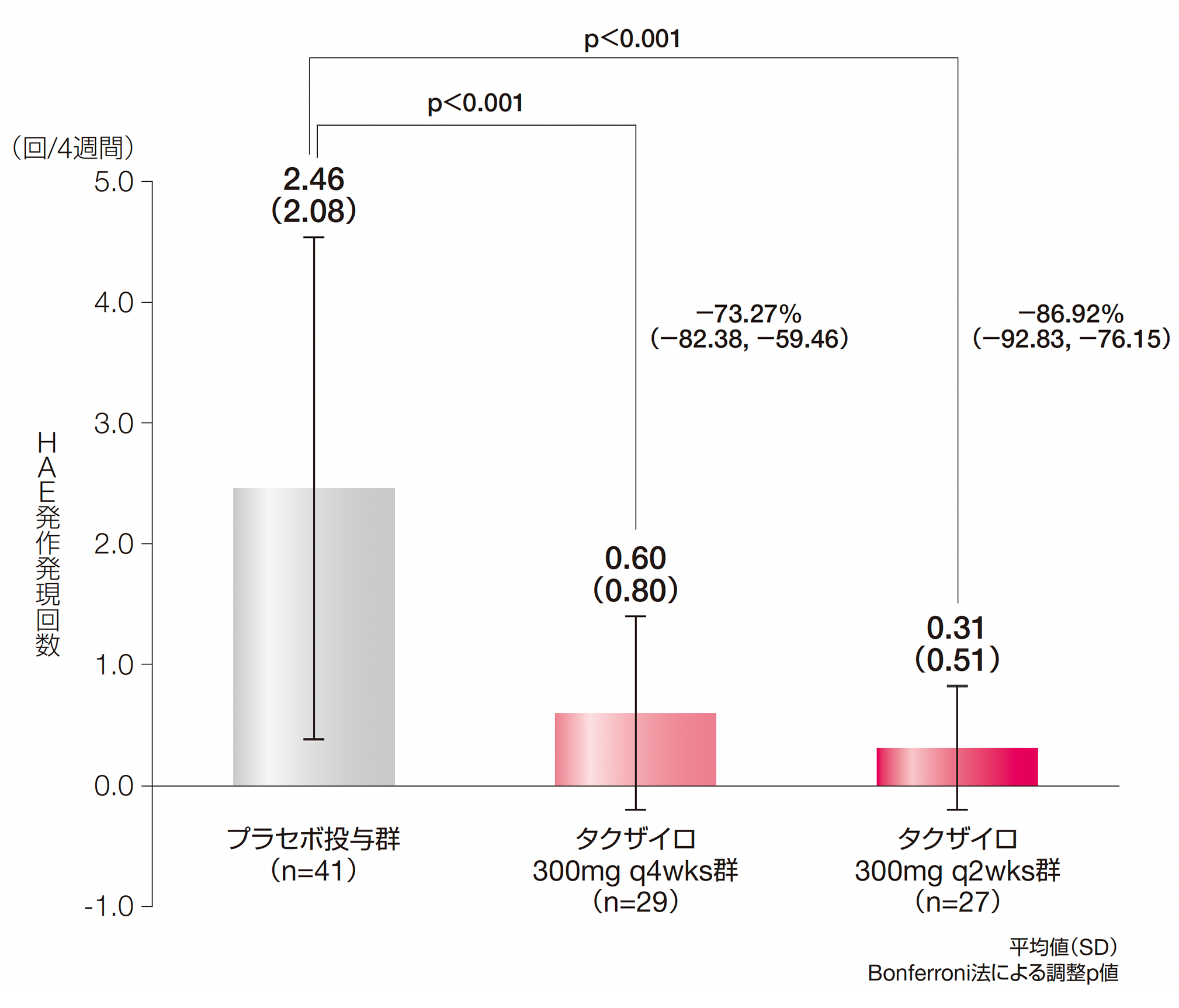
投与群及びベースライン時の発作発現率(回/日)を固定効果とし、投与期間中に観察された各被験者の投与期の観察日数の対数をオフセット変数としたPoisson回帰モデルにより、HAE発作回数の推定及び投与群間の比較を行った。
HAE:遺伝性血管性浮腫、q2wks:2週に1回投与、q4wks:4週に1回投与
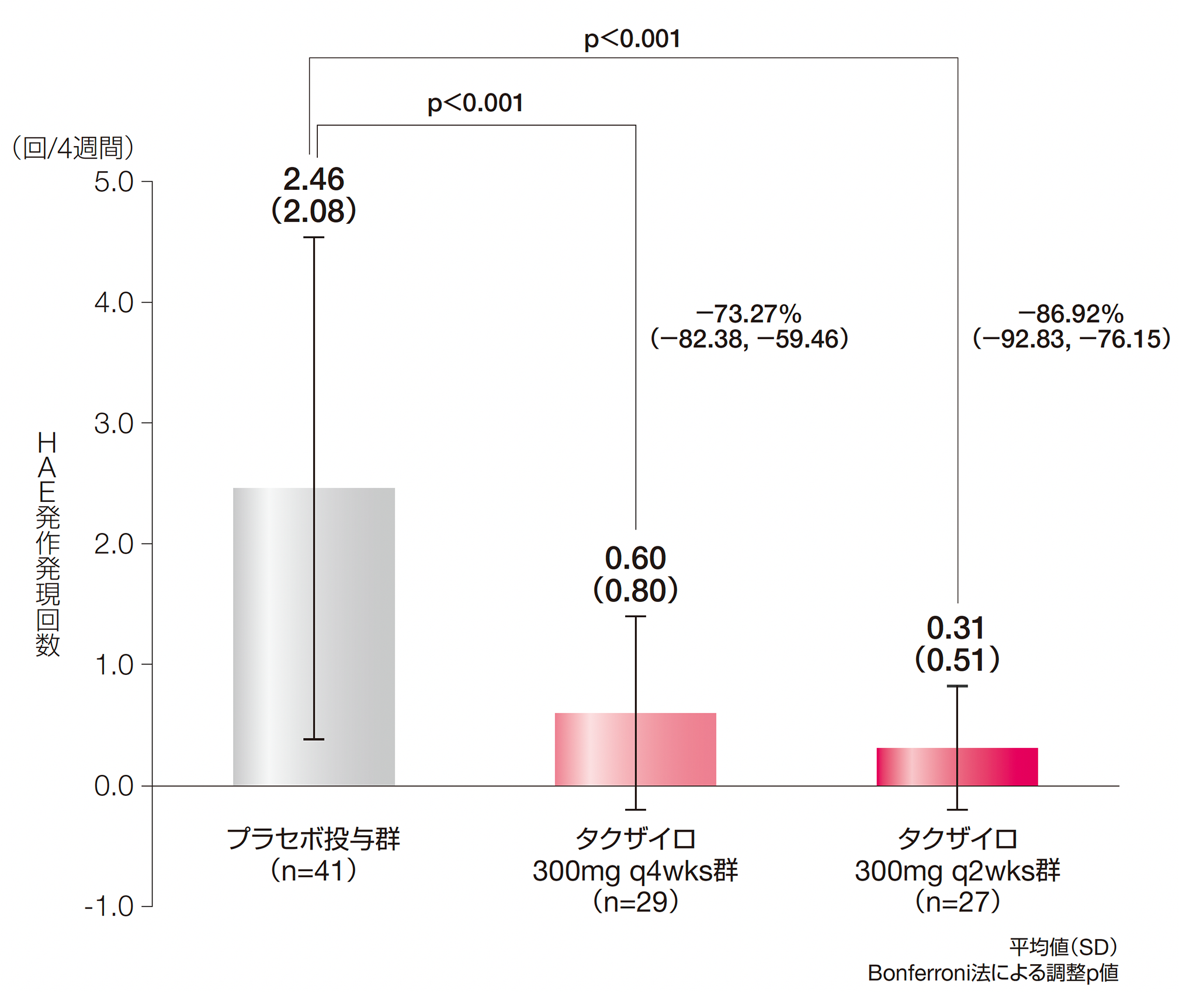
投与群及びベースライン時の発作発現率(回/日)を固定効果とし、投与期間中に観察された各被験者の投与期の観察日数の対数をオフセット変数としたPoisson回帰モデルにより、HAE発作回数の推定及び投与群間の比較を行った。
HAE:遺伝性血管性浮腫、q2wks:2週に1回投与、q4wks:4週に1回投与
【参考情報】AE-QoL質問票各スコアの変化量(その他の評価項目)
プラセボ投与群及びタクザイロ各投与群のAE-QoL質問票の総スコア及び4つの領域スコア[機能、疲労/気分、恐怖/羞恥及び栄養(食事)]のDay 0~182までの変化量の最小二乗平均(SD)は以下のとおりでした。
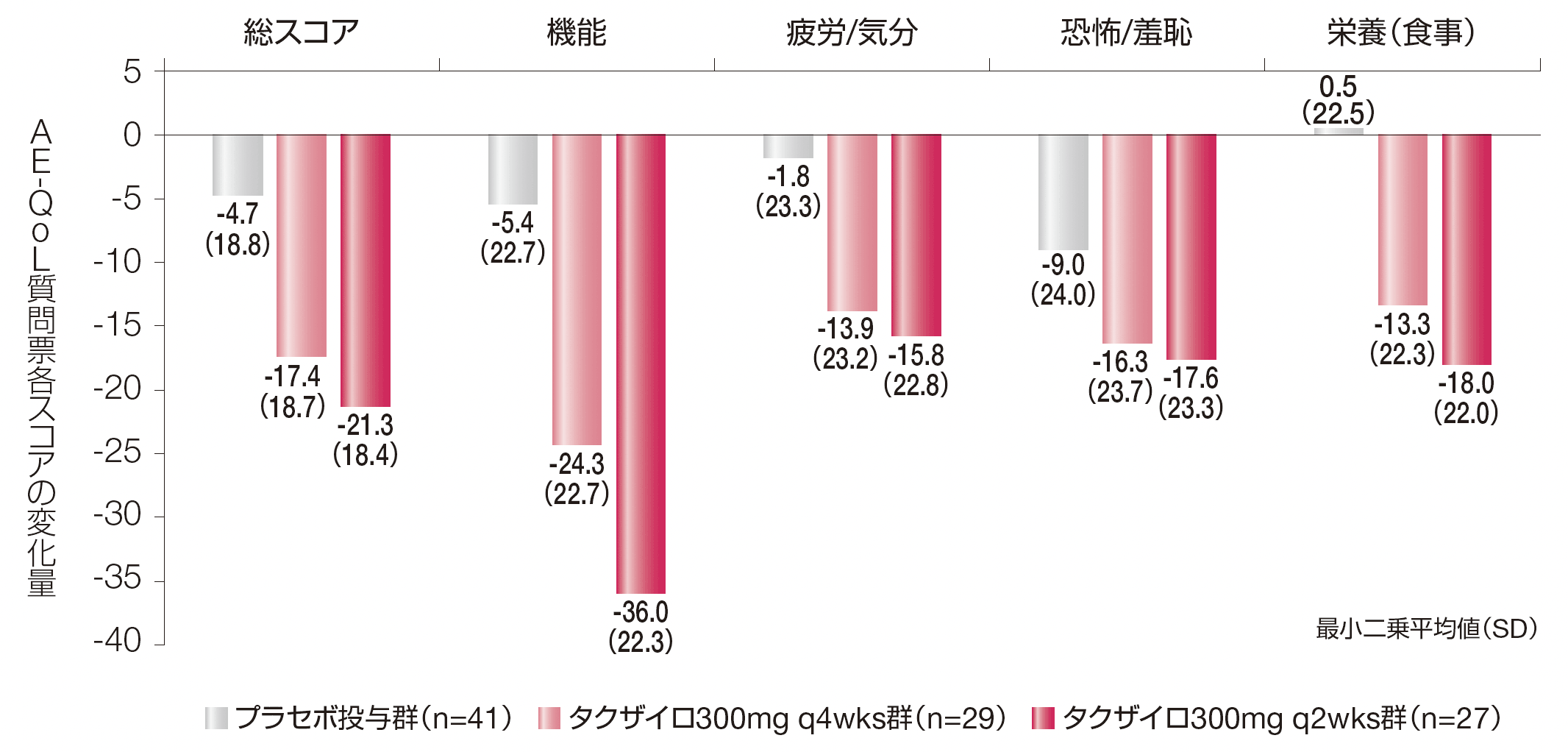
AE-QoL質問票は血管性浮腫に特化した自己記入式のQoL評価ツールであり、質問票の17項目を1(まったくなし)~ 5(非常に多い)の5段階で評価する。各項目のスコアを集計し、総スコア及び4つの領域スコア[機能、疲労/気分、恐怖/羞恥及び栄養(食事)]を求めた。得られた領域スコア(当該領域に含まれる項目スコアの平均値)及び総スコア(全ての項目スコアの平均値)を、一次変換で最終的なパーセンテージスコア(0 ~100)に変換した。スコアが大きいほどQoLが低いことを示す。
AE-QoL:血管性浮腫に伴うQoL、q2wks:2週に1回投与、q4wks:4週に1回投与、SD:標準偏差
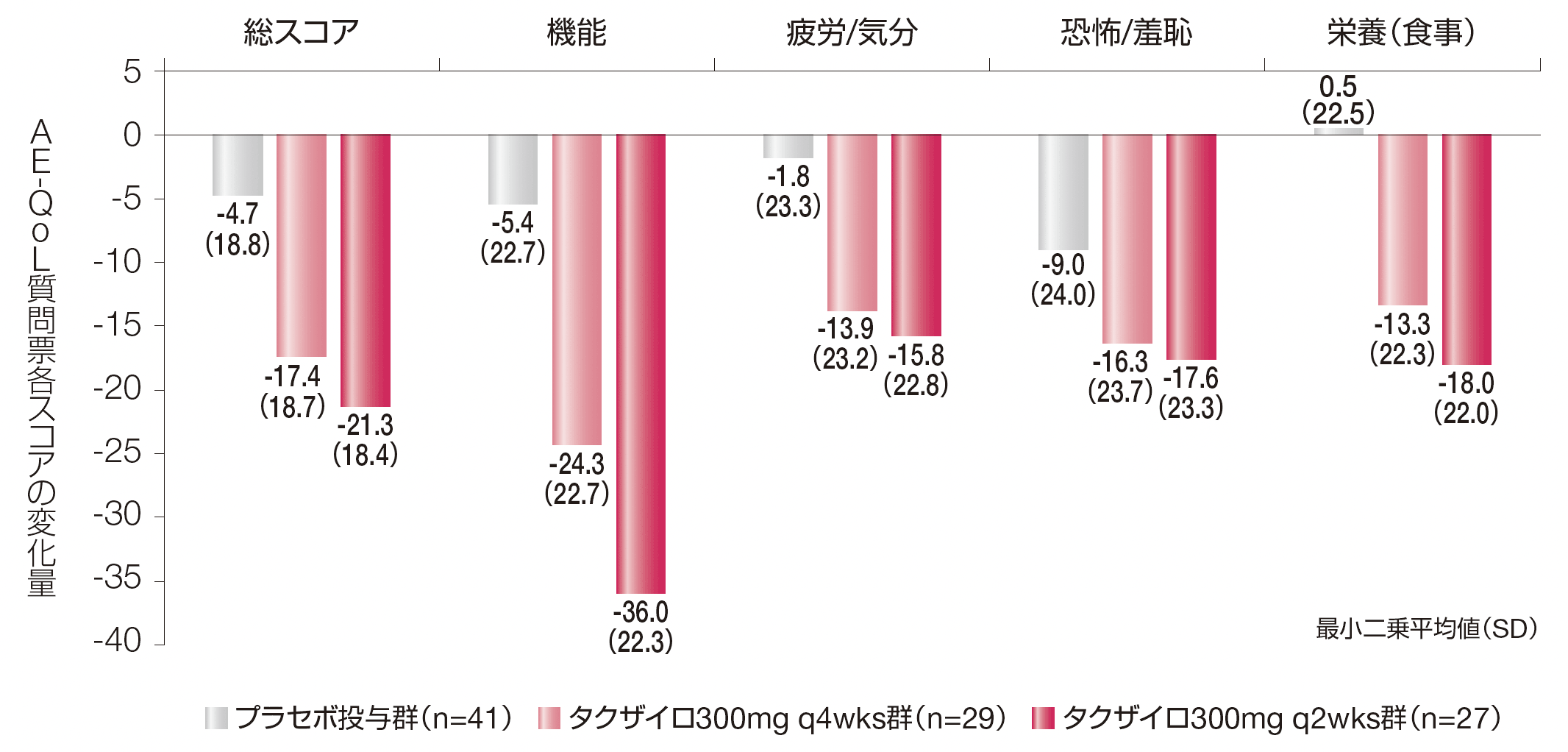
AE-QoL質問票は血管性浮腫に特化した自己記入式のQoL評価ツールであり、質問票の17項目を1(まったくなし)~ 5(非常に多い)の5段階で評価する。各項目のスコアを集計し、総スコア及び4つの領域スコア[機能、疲労/気分、恐怖/羞恥及び栄養(食事)]を求めた。得られた領域スコア(当該領域に含まれる項目スコアの平均値)及び総スコア(全ての項目スコアの平均値)を、一次変換で最終的なパーセンテージスコア(0 ~100)に変換した。スコアが大きいほどQoLが低いことを示す。
AE-QoL:血管性浮腫に伴うQoL、q2wks:2週に1回投与、q4wks:4週に1回投与、SD:標準偏差
安全性
1. 有害事象の発現頻度(HAE発作関連事象を除く)
治験薬を1回以上SC投与した安全性解析対象における治験薬との因果関係を否定できない有害事象(副作用)は、プラセボ投与群で34.1%(14/41例)、タクザイロ300mg q4wks群で48.3%(14/29例)、タクザイロ300mg q2wks群で70.4%(19/27例)に認められました。
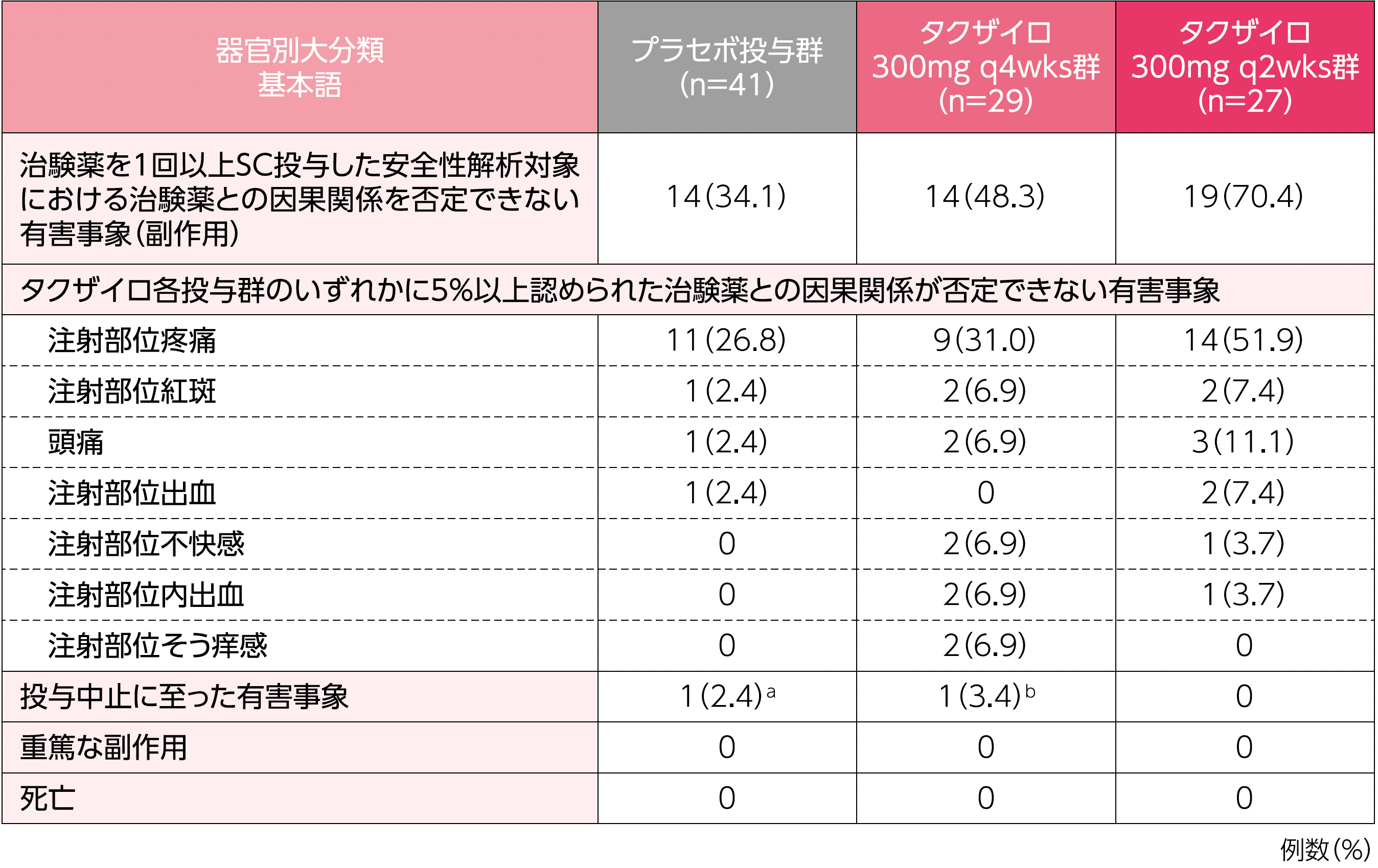
a:緊張性頭痛で転帰は回復 b:ALT増加及びAST増加で転帰は軽快
a:緊張性頭痛で転帰は回復 b:ALT増加及びAST増加で転帰は軽快
2. 治療継続率
本試験において投与期間を完了した被験者の割合は、プラセボ投与群85.4%(35/41例)、タクザイロ300mg q4wks群89.7%(26/29例)、タクザイロ300mg q2wks群92.6%(25/27例)でした。本試験を完了しなかった被験者の割合は、プラセボ投与群14.6%(6/41例)、タクザイロ300mg q4wks群10.3%(3/29例)、タクザイロ300mg q2wks群7.4%(2/27例)でした。
3. 特に注目すべき有害事象(AESI)の発現頻度
治験責任医師が報告したAESIの発現頻度は、プラセボ投与群で0%(0/41例)、タクザイロ300mg q4wks群で3.4%[(1/29例)、注射部位紅斑]、300mg q2wks群で11.1%[(3/27例)、小球性貧血、注射部位反応、過敏症が各1例]でした。これらはいずれも軽度又は中等度であり、小球性貧血を除き、治験薬との因果関係は否定されませんでした。
試験概要(詳細)
目的
Ⅰ型又はⅡ型の遺伝性血管性浮腫(HAE)患者を対象として、タクザイロの有効性及び安全性を検討する。
対象
HAE(Ⅰ型又はⅡ型)患者126例
試験方法
スクリーニング期では、HAEの長期予防的治療(LTP)を受けていない12歳以上の対象患者に対し、スクリーニング評価を実施した。LTPを受けていた患者では、18歳以上の患者にのみ、2週間以上の休薬期間完了後にスクリーニング評価を実施した。導入期では、ベースラインのHAE発作発現回数を評価した。導入期(4週間)にHAE発作を1回以上発現した被験者は投与期へ組み入れ可能とし、導入期完了前にHAE発作が3回以上発現した場合は、早期に終了し投与期へ組み入れた。導入期間中にHAE発作を1度も発現しなかった被験者は、導入期をさらに4週間延長した。投与期では、二重盲検下で2:1の割合でタクザイロ投与群[150mg q4wks(4週に1回投与)群、300mg q4wks群、300mg q2wks(2週に1回投与)群]又はプラセボ投与群のいずれかに割り付け、26週間反復皮下投与した。本剤投与群に組み入れられた被験者は3つの用法・用量に1:1:1で割り付けた。投与期間終了後、長期投与試験(DX-2930-04試験)又は8週間の追跡調査(安全性、薬力学及び薬物動態評価)を実施した。
HAE発作評価・報告手順(HAARP)を作成し、HAE発作の情報を収集、報告及び評価した。HAE発作は、以下の部位のうち少なくとも1カ所で発作の発現を示す症状又は徴候と定義した。 ・末梢の血管性浮腫:四肢、顔面、頸部、体幹、泌尿生殖器領域の皮膚の腫脹 ・腹部の血管性浮腫:腹痛(腹部膨満、悪心、嘔吐、下痢の有無を問わない) ・喉頭の血管性浮腫:喘鳴、呼吸困難、発話困難、嚥下困難、咽喉絞扼感、舌・口蓋・口蓋垂・喉頭の腫脹
評価項目
主要評価項目:投与期間中(Day 0~182)に治験責任医師が確認したHAE発作発現回数(検証項目)
安全性評価項目:重篤な有害事象及び特に注目すべき有害事象(AESI)を含むすべての有害事象、治療継続率 等
その他の評価項目:血管性浮腫に伴うQoL(AE-QoL)質問票各スコアの変化量 等
解析計画
有効性解析は、ITT解析対象集団を用いて実施し、投与期間(Day 0~182)を有効性の評価期間とした。有意水準は5%とした。投与群及びベースライン時の発作発現率(回/日)を固定効果とし、投与期間中に観察された各被験者の投与期の観察日数の対数をオフセット変数としたPoisson回帰モデルを用いてタクザイロ各投与群とプラセボ投与群とを比較した。各投与群のHAE発作発現回数の最小二乗平均とその95%信頼区間(CI)、タクザイロ各投与群の平均発作発現回数の低下率(対プラセボ投与群)とその95%CIを推定した。なお、多重性を考慮してBonferroni法に基づいて調整p値を算出した(検証項目)。有害事象は、HAE発作関連事象を除いて集計した。AE-QoL質問票の各項目に対する回答及びAE-QoL総スコア及び4つの領域スコア[機能、疲労/気分、恐怖/羞恥及び栄養(食事)]は安全性解析対象集団を用いてプラセボ投与群及びタクザイロ各投与群について要約した。
注意 6.用法及び用量
通常、成人及び12歳以上の小児には、ラナデルマブ(遺伝子組換え)として1回300mgを2週間隔で皮下注射する。なお、継続的に発作が観察されず、症状が安定している場合には、1回300mgを4週間隔で皮下注射することもできる。