タクザイロ皮下注300mgシリンジ 発売中
国内第Ⅲ相臨床試験
「禁忌を含む注意事項等情報」は電子添文をご参照ください。
国内第Ⅲ相臨床試験(SHP643-302試験)1)
1)社内資料(承認時評価資料):ラナデルマブの遺伝性血管性浮腫患者を対象とした国内第Ⅲ相試験成績
試験概要
目的
日本人遺伝性血管性浮腫(HAE)患者を対象にタクザイロ300mgを反復皮下投与したときの有効性及び安全性を評価する。
対象
HAE(Ⅰ型又はⅡ型)患者12例
評価項目
主要評価項目:Day 0 ~182における無発作状態を達成した被験者の割合
有効性におけるその他の評価項目:各有効性評価期間中に治験責任医師が確認したHAE発作発現回数とベースラインからの平均低下率 等
安全性評価項目:有害事象 等
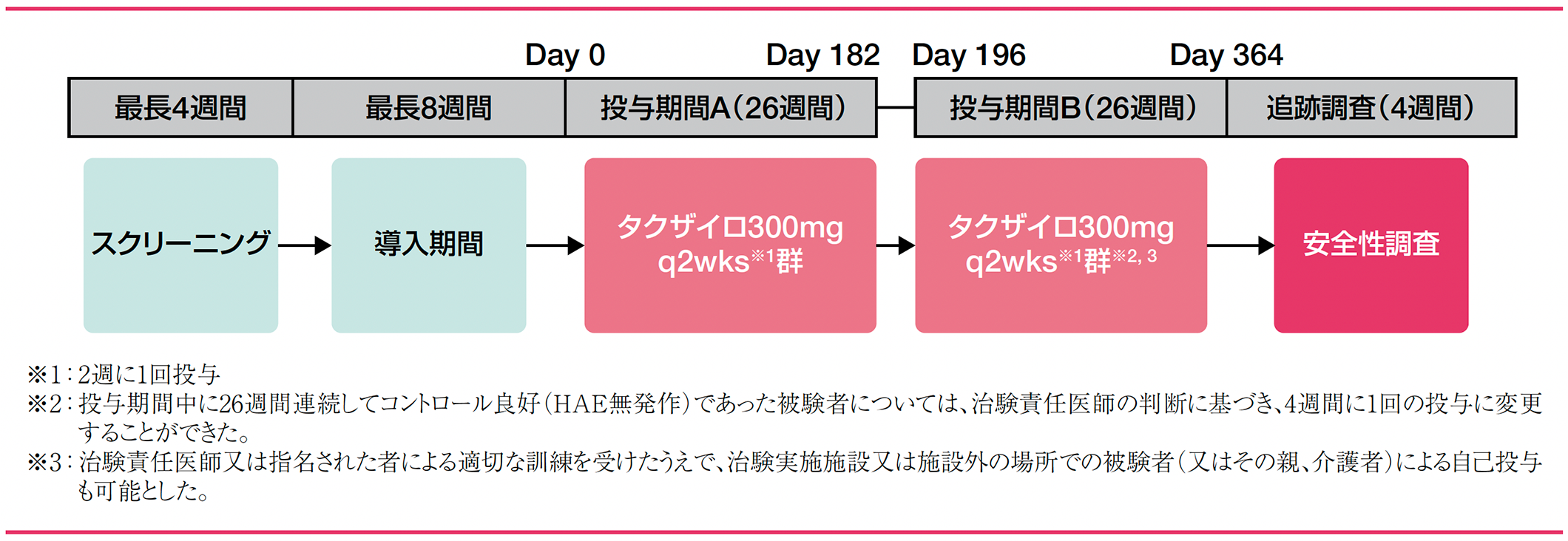
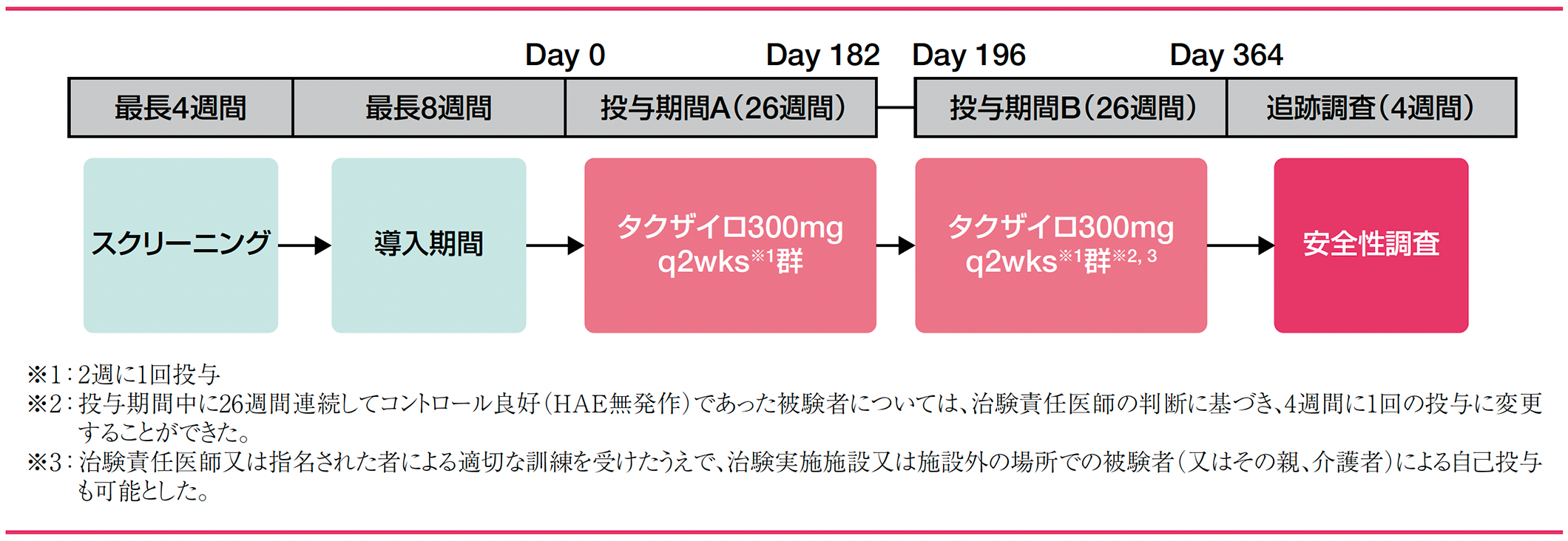
試験デザイン
患者背景
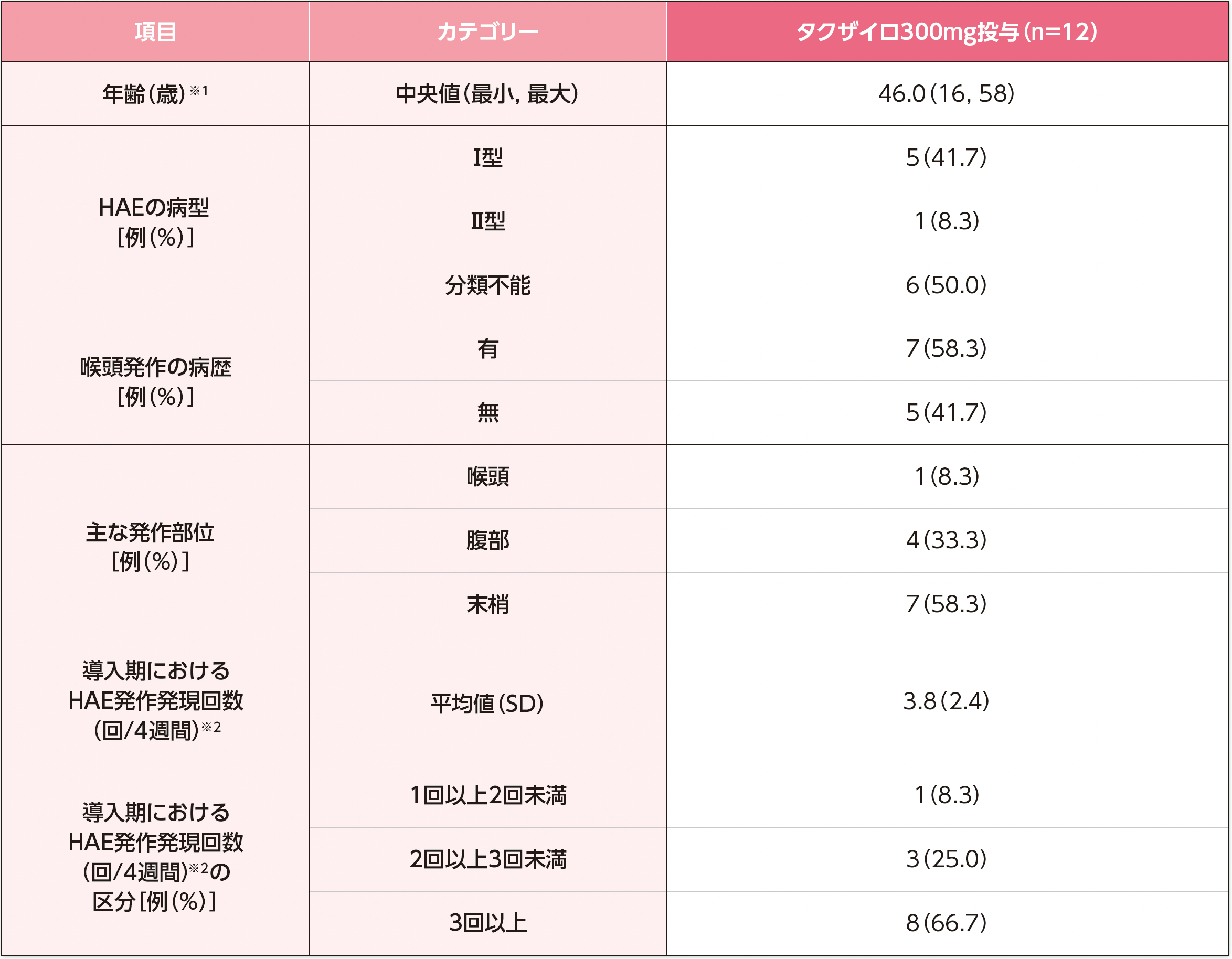
※1:インフォームドコンセントによる同意取得日の年齢。
※2:導入期のHAE発作発現回数は、導入期間中に発生したHAE発作発現回数を導入期の日数で除し、28日を乗じて算出した。
HAE:遺伝性血管性浮腫、SD:標準偏差
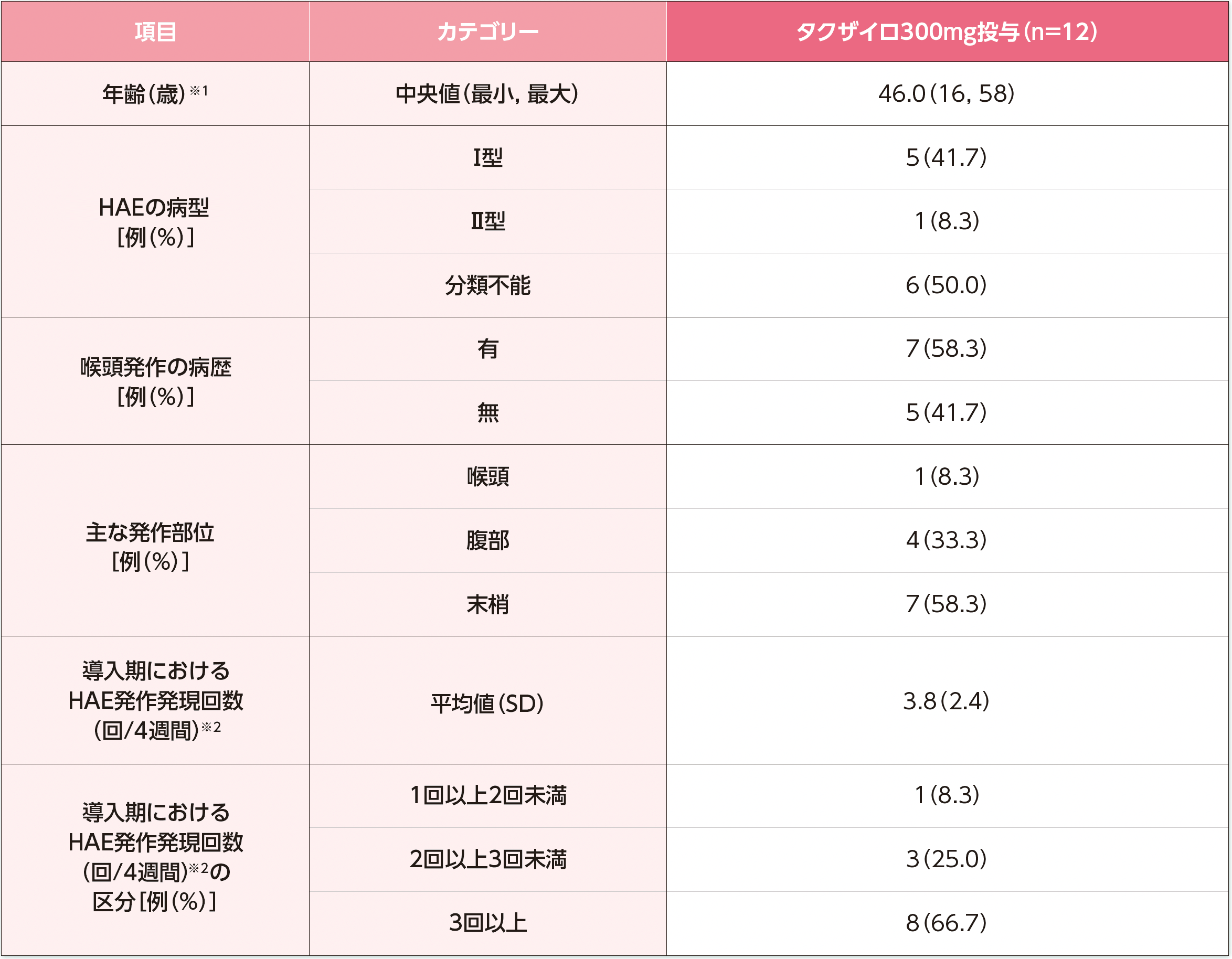
※1:インフォームドコンセントによる同意取得日の年齢。
※2:導入期のHAE発作発現回数は、導入期間中に発生したHAE発作発現回数を導入期の日数で除し、28日を乗じて算出した。
HAE:遺伝性血管性浮腫、SD:標準偏差
有効性
1.Day 0~182における無発作状態を達成した被験者の割合(主要評価項目)
Day 0~182に無発作であった被験者の割合は、41.7%(5/12例)でした。
2. 各有効性評価期間中に治験責任医師が確認したHAE発作発現回数とベースラインからの平均低下率(有効性におけるその他の評価項目)
各有効性評価期間中のHAE発作発現回数の4週間あたりの平均値(SD)は、Day 0~182で1.17回(2.50)、Day 0~364で1.21回(2.60)、Day 70~182で1.14回(2.51)、Day 70~364で1.20回(2.63)でした。ベースラインからの平均低下率(SD)はDay 0~182で-77.10%(29.15)、Day 0~364で-73.97%(35.39)、Day 70~182で-80.29%(26.20)、Day 70~364で-74.40%(34.62)でした。
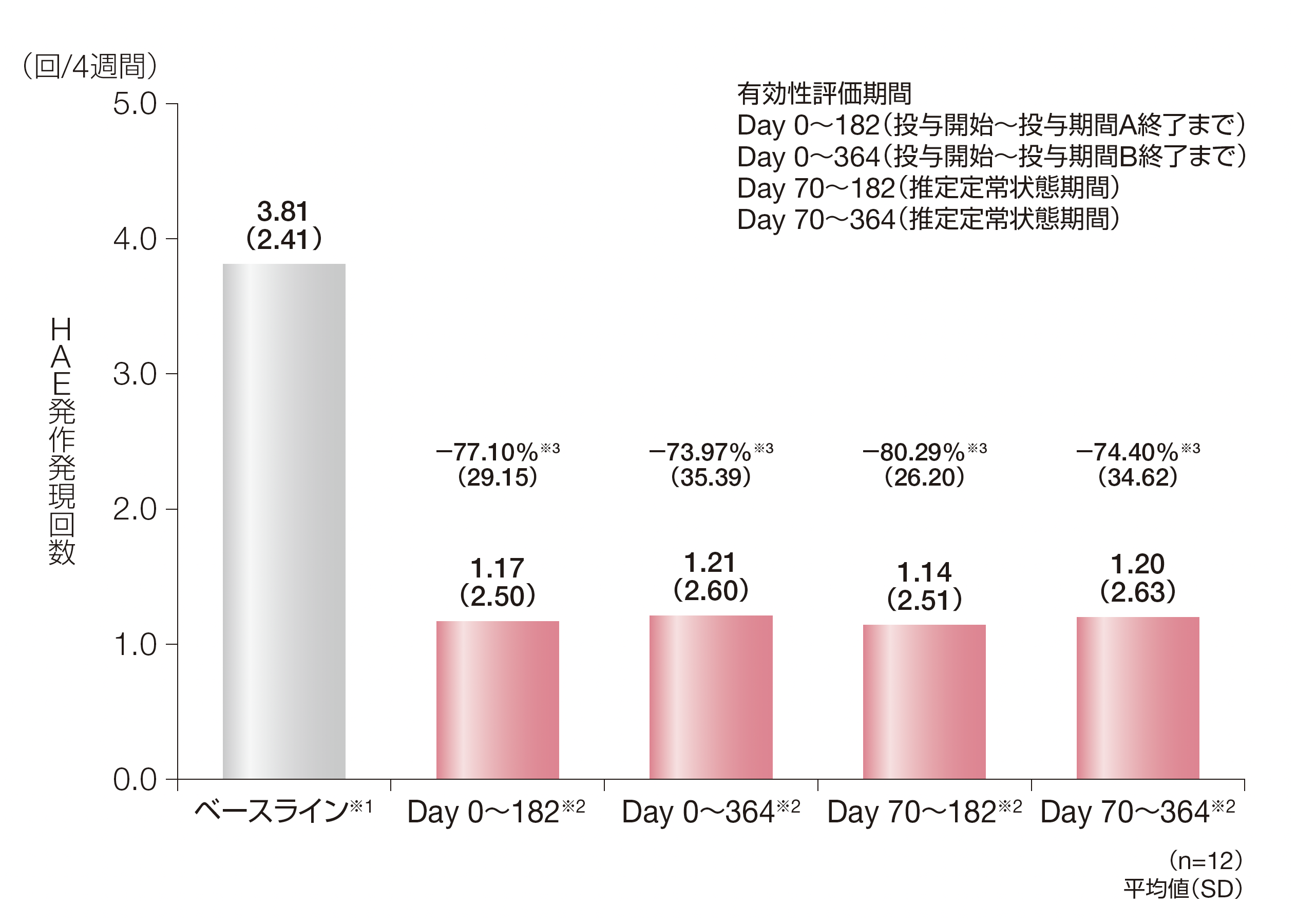
※1:ベースラインに治験責任医師が確認したHAE発作発現回数は、被験者ごとに、導入期間に治験責任医師が確認したHAE発作発現回数をその投与期間の日数で除し、28日を乗じた。
※2:投与期間中に治験責任医師が確認したHAE発作発現回数は、被験者ごとに、投与期間に治験責任医師が確認したHAE発作発現回数をその投与期間の日数で除し、28日を乗じた。
※3:4週間あたりのHAE発作発現回数のベースラインからの低下率は、100%×(投与期間中の4週間あたりのHAE発作発現回数−ベースラインの4週間あたりのHAE発作発現回数)/ベースラインの4週間あたりのHAE発作発現回数で算出した。
HAE:遺伝性血管性浮腫、SD:標準偏差
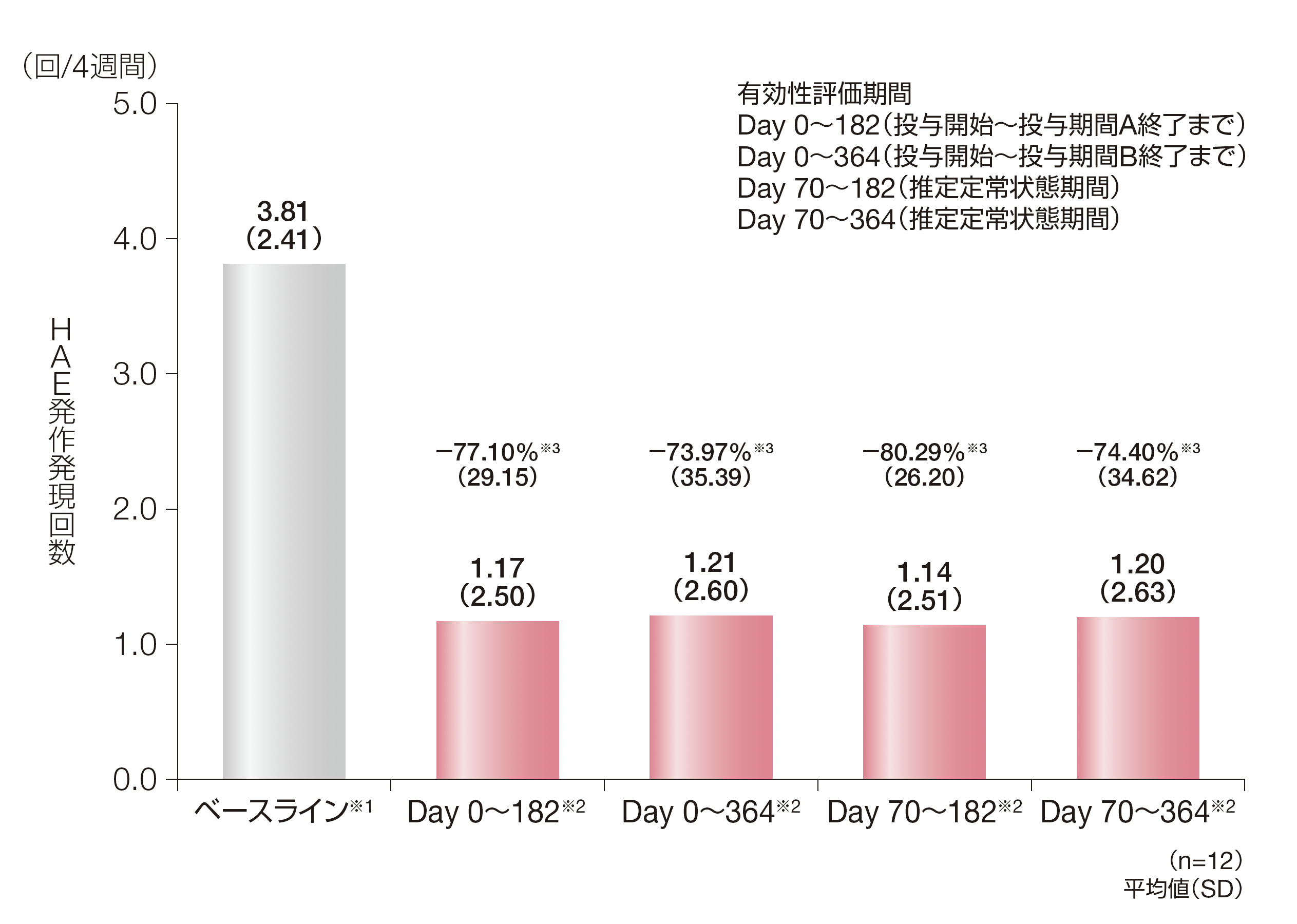
※1:ベースラインに治験責任医師が確認したHAE発作発現回数は、被験者ごとに、導入期間に治験責任医師が確認したHAE発作発現回数をその投与期間の日数で除し、28日を乗じた。
※2:投与期間中に治験責任医師が確認したHAE発作発現回数は、被験者ごとに、投与期間に治験責任医師が確認したHAE発作発現回数をその投与期間の日数で除し、28日を乗じた。
※3:4週間あたりのHAE発作発現回数のベースラインからの低下率は、100%×(投与期間中の4週間あたりのHAE発作発現回数−ベースラインの4週間あたりのHAE発作発現回数)/ベースラインの4週間あたりのHAE発作発現回数で算出した。
HAE:遺伝性血管性浮腫、SD:標準偏差
安全性
1. 有害事象の発現頻度(HAE発作関連事象を除く)
治験薬との因果関係が否定できない有害事象は、タクザイロ300mgを1回以上皮下投与した被験者(全症例)で66.7%(8/12例)に認められました。
本試験において、重篤な副作用、投与中止に至った有害事象、死亡例は認められませんでした。
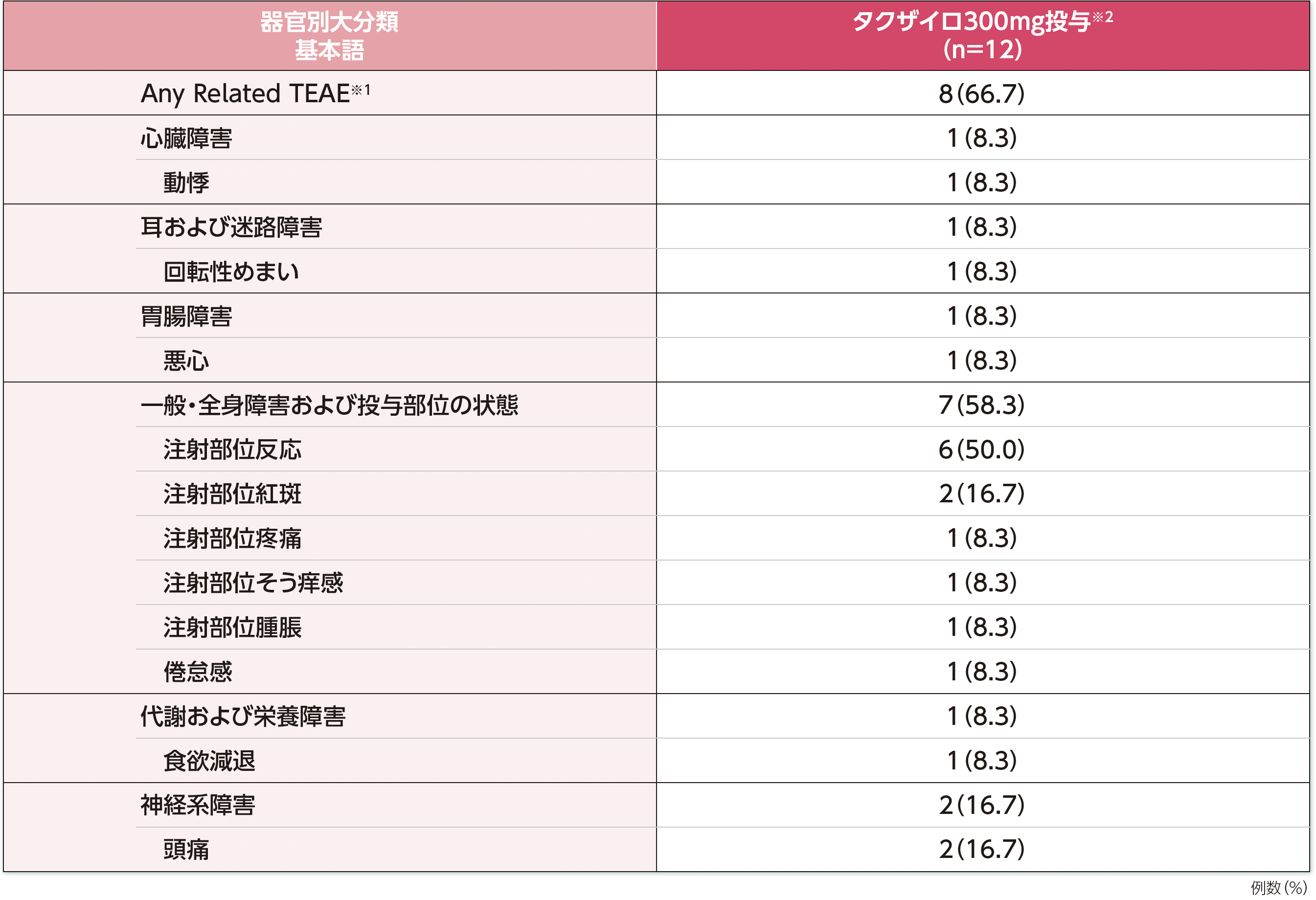
※1:TEAEは、治験薬の投与開始後に発現した有害事象又は治験薬の投与開始前から発現していたが、投与開始後に重症度が悪化した又は治験薬と関連ありと判断された有害事象と定義する。因果関係が否定できないTEAEは、治験責任医師により治験薬との因果関係があると判断されたTEAEとした。
※2:投与期間Bでは投与期間Aと同じ2週に1回の用法で投与したが、投与期間中に26週間連続してコントロール良好(無発作)であった被験者については、治験責任医師の判断に基づき、4週に1回投与へ変更可能とした。
HAE:遺伝性血管性浮腫、TEAE:治験薬投与後に(試験治療下で)発現した有害事象
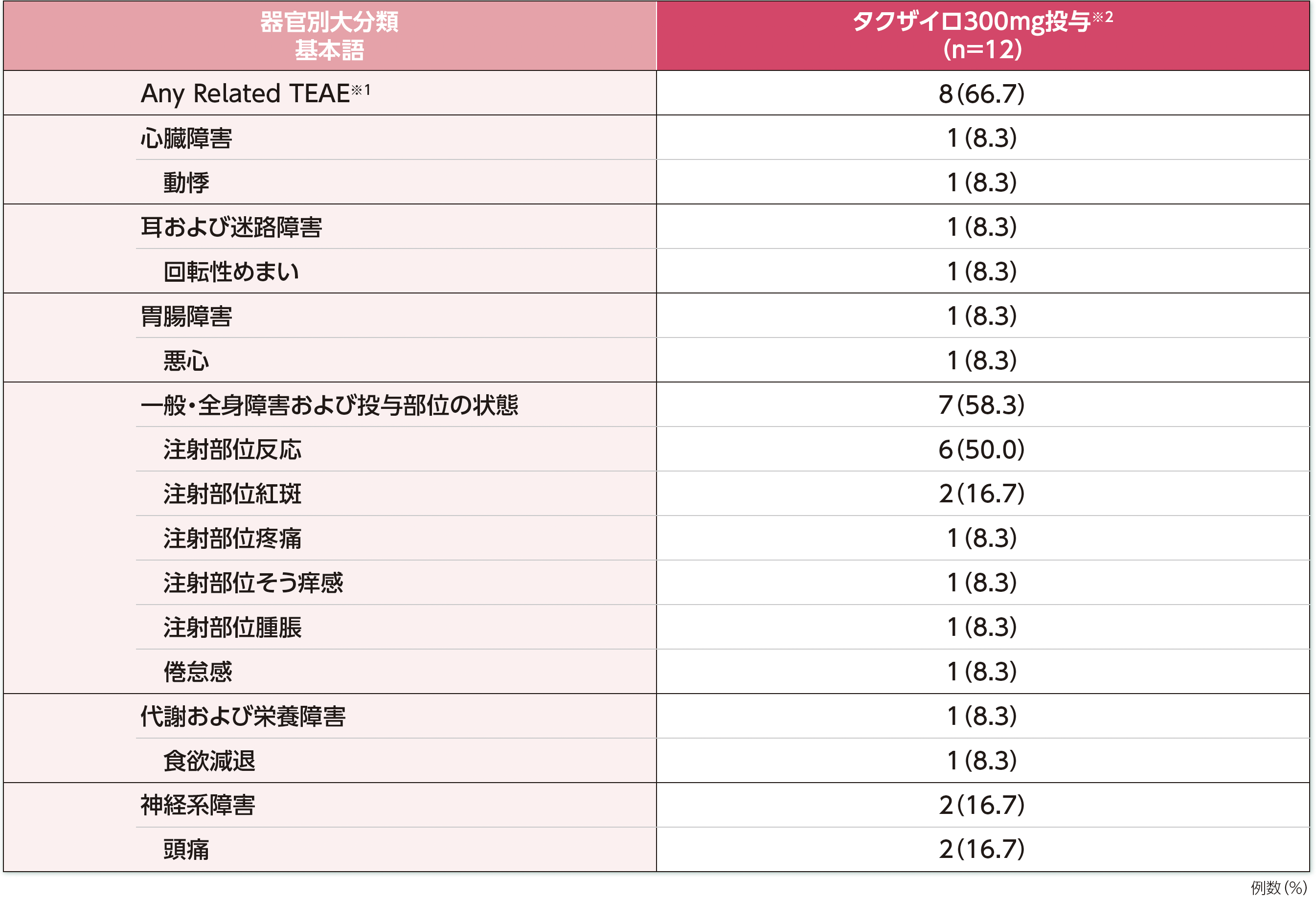
※1:TEAEは、治験薬の投与開始後に発現した有害事象又は治験薬の投与開始前から発現していたが、投与開始後に重症度が悪化した又は治験薬と関連ありと判断された有害事象と定義する。因果関係が否定できないTEAEは、治験責任医師により治験薬との因果関係があると判断されたTEAEとした。
※2:投与期間Bでは投与期間Aと同じ2週に1回の用法で投与したが、投与期間中に26週間連続してコントロール良好(無発作)であった被験者については、治験責任医師の判断に基づき、4週に1回投与へ変更可能とした。
HAE:遺伝性血管性浮腫、TEAE:治験薬投与後に(試験治療下で)発現した有害事象
試験概要(詳細)
目的
日本人遺伝性血管性浮腫(HAE)患者を対象にタクザイロ300mgを反復皮下投与したときの有効性及び安全性を評価する。
対象
HAE(Ⅰ型又はⅡ型)患者12例
試験方法
タクザイロ300mgを腹部、大腿部又は上腕に皮下注射した。投与期間A(Day 0〜182)では、全被験者に本剤300mgを2週間に1回(q2wks)、合計14回(26週間)投与した。投与期間A(Day 0〜182)の完了後、被験者は投与期間B(Day 196〜364)に移行した。投与期間Bでは、投与期間A(Day 0〜182)の用法を継続して2週間に1回投与したが、投与期間A(Day 0〜182)の26週間に連続してコントロール良好(HAE無発作)であった被験者については、治験責任医師の判断に基づき、4週間に1回(q4wks)の投与に変更することができた。投与期間Bの終了後は、4週間の安全性追跡調査を行った。
治験薬の投与は、投与期間Bにおいてのみ治験責任医師又は指名された者による適切な訓練を受けたうえで、治験実施施設又は施設外の場所での被験者(又はその親、介護者)による自己投与も可能とした。
評価項目
主要評価項目:Day 0〜182における無発作状態を達成した被験者の割合
有効性におけるその他の評価項目:各有効性評価期間中に治験責任医師が確認したHAE発作発現回数とベースラインからの平均低下率 等
安全性評価項目:有害事象 等
解析計画
有効性解析は、最大の解析対象集団(FAS)を用いて実施した。FASは、本剤の投与を1回以上受けた全被験者とした。また統計的仮説検定は行わなかった。主要評価項目は、有効性評価期間中に治験責任医師が確認したHAE発作を発現しなかった場合に当該有効性評価期間中に無発作であったとみなし、有効性評価期間中に投与を中止した被験者では投与中止の時点で当該評価期間を終了し、被験者の当該評価期間での経過時間に対する無発作状態を評価した。Day 0〜182の有効性評価期間に無発作状態を達成した被験者数及び割合を要約し、正確法を用いて95%信頼区間(CI)を算出した。その他の評価項目は、各有効性評価期間中の治験責任医師が確認したHAE発作について、発作発現回数を正規化し、4週間あたりのHAE発作発現回数として示した。また、月ごと(28日間隔)の治験責任医師が確認したHAE発作発現回数も同様に要約して示した。