HORIZON Expert Interview リアルワールドデータの現在地


臨床研究拠点としての役割
~国立病院機構における臨床研究への取り組みと名古屋医療センターでの支援体制~
全国140の医療機関によって構成される国立病院機構(NHO)では、そのミッションの1つとして「質の高い臨床研究、教育研修の推進」を掲げています。大学病院のような研究基盤をもたないNHOの各医療機関では、そのネットワークを活かした多施設共同研究など、主に実臨床で得られるデータを用いた臨床研究に力を入れてきました。NHO内では公募型研究助成を毎年行うなど、実臨床で活躍する医師やコメディカルが臨床研究に取り組むための環境も整えています。
そうした臨床研究の拠点となるのが、全国10カ所に設置された「臨床研究センター」です。私たち名古屋医療センターの臨床研究センターは、血液・造血器疾患分野における準ナショナルセンターとしての役割を担っていた歴史もあり、数多くの臨床研究を推進し、その結果を広く発信してきました。また、当センターは臨床研究を推進・支援する組織であるAcademic Research Organization(ARO)1)を有し、臨床研究の立ち上げや実施のサポートという点でも強みをもちます。クリニカルクエスチョンに基づくリサーチクエスチョンの設定、研究計画の策定から、統計解析・結果発表まで一貫してかかわってきました。
臨床研究の実施に向けた支援の必要性
~クリニカルクエスチョンからリサーチクエスチョンへの転換、臨床研究の計画・立案のハードルは高い~
私たち医師は、最適な治療選択を目指して、これまで蓄積されたエビデンスを参考にしながら日々の診療を行っています。したがって、今後もより良い医療を実践していくためには、日々変化する医療環境に沿った新たなエビデンスを、臨床研究を通じて継続的に創出していくことが求められます。
しかしながら、研究倫理への配慮はもちろんのこと、法律に準拠した計画・運営・報告といった臨床研究に対する規制強化もあり、日常診療のなかでクリニカルクエスチョンを見出したとしても、それを臨床研究の実施へとつなげていくことのハードルは高くなってきました。また、これまでの医師教育において、臨床研究に関する指導は十分ではなかったことも問題です。臨床医がクリニカルクエスチョンをリサーチクエスチョンへと転換し、適切な方法を選択しながら、結果の発表まで結びつけるという一連の流れに取り組むためには、支援システムの充実も重要なポイントです。
そうしたなかで、当センターのAROでは、臨床研究にかかわるあらゆる事項に関する「研究相談」を行ってきました。そのなかで、多くに共通した問題点は、クリニカルクエスチョンを具体的なリサーチクエスチョンへと転換するとともに、倫理的な問題や実現の可能性を評価しながら、臨床研究の
計画・立案へとつなげるところだと感じています。
そこで、私たちのAROでは、医療者が臨床研究へ取り組むためのきっかけづくりにも力を入れてきました。たとえば、先日は臨床研究の支援に携わる先生方に協力をいただき、医療者から臨床研究に関して気軽な質問を受け付ける「何でも研究相談会」という企画を院内で行いましたが、利用者からは「このようなアイディアは臨床研究になりますか」「この問題を解決するために、有効な文献検索の方法を教えてください」といった質問も多数寄せられています。こうした状況を考えると、医療者の臨床研究に対する興味・関心を掬い上げながら、実施へと橋渡しする支援のニーズは大きく、今後も継続的な取り組みが必要になると考えています。
日本における臨床研究の実施課題
~進捗の遅れなどをどのように解決していくのか~
たとえば、日本の臨床研究グループとして代表的な日本臨床腫瘍研究グループ(JCOG)では、数多くのプロスペクティブな多施設共同臨床試験を実施しながら、有効性の高い新たな標準治療を確立してきました。JCOGは1978年の設立以来、世界に向けてインパクトのある研究結果を発信し続けています。JCOGは、公的研究費を中心として運用されている研究グループで、データセンターをはじめ十分に整備された基盤の上運営されており、高い信頼性のある臨床研究を行っています。ただ、同様な精度の研究を自分たちだけで行うのは、中々困難だと思います。
さらに、2018年に施行された臨床研究法により、臨床研究に伴う書類作成や進捗報告などの負担が大きく増したことで、最近は臨床試験の実施数も減少傾向にあると感じます。十分な研究資金が得られれば、そうした作業をContract Research Organization(CRO)へ委託することもできますが、それが可能な臨床試験の数は限られているのが実情です。臨床研究の進捗が遅れれば、多くの問題を引き起こします。治療の進歩が早い領域であれば、結果が得られるころには、対照群とした標準治療が実臨床と合致しなくなってしまうといったケースも想定されるでしょう。試験の実施費用も多くなります。機動力をもって臨床研究を遂行することへの支援は不可欠だと言えます。
こうした背景もあり、厚生労働省は、国際水準の臨床研究や医師主導治験の中心的役割を担う大学病院をはじめとした全国15の医療機関を「臨床研究中核病院」として承認しています2)。国の支援のもと、臨床研究に必要な人材の獲得や環境の整備が行われています。
RWD研究における近年の取り組みと今後の方向性
~患者個人に病歴や治療歴を紐付けるかたちで集約する新たなデータベースが期待される~
このような臨床試験を取り巻く環境もあり、近年はリアルワールドデータ(RWD)を活用して創出するリアルワールドエビデンス(RWE)にも注目が集まっています。米国食品医薬品局(FDA)や欧州医薬品庁(EMA)も、薬事承認のためのエビデンスとしてRWEを利用する可能性を示唆するなど3, 4)、世界的にもその活用に向けた取り組みが推進されてきました。
当然、日本の医療界においても「RWD研究」「RWE」という言葉が用いられる機会は増加していますが、どのようなRWDを用いてRWEを構築し、それらをどのように活用していくかといった点についての議論は、十分になされていないのが現状だと感じています。ただし、ビッグデータの時代にあって、数多くのRWD研究が報告されつつあり、その重要性は今後も増していくと予想されます。
また、これまでの日本のRWD研究においては、DPC(Diagnosis Procedure Combination)やレセプトなどのデータベースが用いられることも多かったと思います。しかしながら、これらのRWDを用いて研究を行う場合、データのクリーニングなどに膨大な労力を要し、意義のある結果に結びつけることが難しいケースもありました。また、臨床検査データなどとの紐付けもないため、解析できる内容にも限界があります。
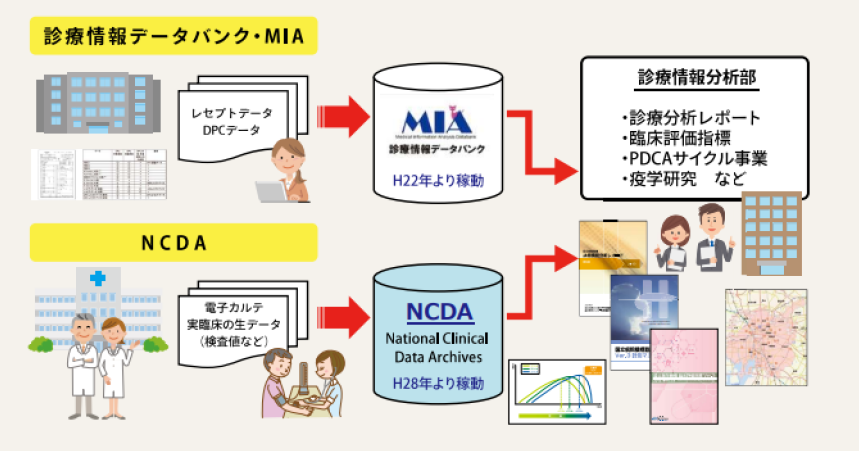
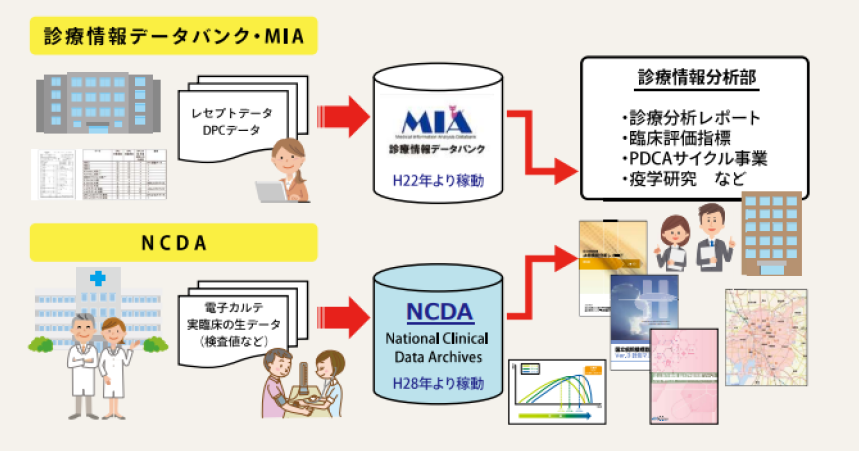
さらに、電子カルテを標準化することが難しく、まだ十分に活用されていないRWDは数多く存在すると考えます。RWD研究の進展に向けては、そうした基盤の整備も必要だと考えられます。全国ネットワークを持ち、急性期から慢性期まで、さまざまな役割を担うNHOの医療機関では、日々膨大な診療データが蓄積されていることから、最近は、これを有効活用する試みも進められています(図1)5)。NHOの全医療機関におけるレセプトおよびDPCデータを収集するデータベースである「診療情報データバンク(MIA:Medical Information Analysis databank)」は、日本における実臨床の全体像を示すデータベースモデルとして、疫学研究などに利用されてきました。さらに、厚生労働省のIT基盤構築事業での活動を経て、電子カルテデータの標準化を進めながら構築された「国立病院機構診療情報集積基盤(NCDA:NHO Clinical Data Archives)」も、RWD研究において活用が期待されるデータベースです。このデータベースでは、疾患や処方情報だけでなく、バイタルサインをはじめとした検査情報、入院記録、食事情報などが紐付けられており、より詳細なデータ解析が可能になると考えられます。
また、疾患レジストリを用いたRWD研究も、これまで数多くのRWEへとつながってきましたが、疾患レジストリは構築・運用において、二重登録の問題への対処など、質を担保するために膨大な労力を要することが多いという課題があります。さらに、アウトカムを収集することが難しく、生存などの重要な指標を評価できないことが多いものです。そのため、今後のRWD研究では、新たなデータベースを次々に立ち上げていくというよりも、患者個人に病歴や治療歴を紐付けるかたちで集約することが求められるのではないでしょうか。個人で統合されたpatient journeyを、AIなどを用いながら解析するといった試みも進められていくものと期待しています。
図1|NHOの診療情報データバンク(MIA)と診療情報集積基盤(NCDA)
独立行政法人 国立病院機構 国立病院機構診療情報収集基盤について~電子カルテデータの標準化から利活用へ~
https://nho.hosp.go.jp/files/000145085.pdf(2023年5月24日参照)
独立行政法人 国立病院機構 国立病院機構診療情報収集基盤について~電子カルテデータの標準化から利活用へ~
https://nho.hosp.go.jp/files/000145085.pdf(2023年5月24日参照)
RWD研究の強みとは
~生存アウトカムの評価や治療の変遷・傾向の把握において強みを発揮する~
このように、RWD研究からのRWE創出には期待が集まるものの、データの交絡などの影響を考えると、現在のところ、治療戦略を変えうるようなエビデンスの創出には、第Ⅲ相臨床試験の実施が不可欠だと思います。その一方で、実臨床における重要なアウトカムの1つは「生存」ですが、これについては第Ⅲ相臨床試験のみでは評価が難しく、RWD研究が強みを発揮する領域だと思います。
たとえば、米国における濾胞性リンパ腫の特徴と治療パターンをプロスペクティブに評価したコホート研究(National LymphoCare Study)では、長期にわたる追跡により、初回の抗体併用化学療法から24カ月以内の疾患進行を示した患者の予後が不良であったことが明らかとなりましたが6)、これはRWD研究が実力を発揮した好事例です。また、米国のSEER(Surveillance Epidemiology and End Results)や日本のがん登録のようなデータベースも、治療の変遷や傾向を知るうえでは有用なエビデンスとなるでしょう。
アンメット・メディカルニーズの解決に向けたRWDとRWEのこれから
~RWD研究の実績が認められるような環境構築がRWEの活用につながっていく~
RWE活用のさらなる広がりとしては、実臨床におけるRWDに加えて、ウェアラブルデバイスで得られるような医療IoT(Internet of Things)との組み合わせにより、未病の実現を目指した早期介入に向けた知見も得られるのではないかと期待されます。さらに、近年は遺伝子パネル検査が普及しつつあり、遺伝子異常をはじめとしたオミックス情報も重要なデータになるでしょう。しかしながら、こうしたオミックス情報は、現在のところ各研究機関・グループ毎での解析に留まることが多く、今後はより広く実臨床を反映したエビデンスの構築に向けた取り組みが求められます。
また、将来的には、RWEがガイドラインなどの根拠として広く活用される時代が到来する可能性もあります。しかしながら、現時点では、RWD研究の方法論や質の担保に関する知識が、臨床医に広く浸透しているとは言い難い状況です。大規模データの活用技術が進歩するなかで、医師に対して広く啓発しながら、RWD研究の実績が認められるような環境をつくっていくことも、今後のRWD研究の発展には欠かせないことだと思います。
臨床研究の計画・実施には苦労もありますが、これからの医療の向上を目指して、若い医師が日常診療におけるクリニカルクエスチョンを発見し、それを検証していくことのできる環境を提供することは、私たちの使命でもあります。そうしたなかで、RWD研究も課題解決の有力な方法になることを期待しています。
1)独立行政法人国立病院機構 名古屋医療センター 臨床研究センター
https://crc.nnh.go.jp/aro/ (2023年5月24日参照)
2)厚生労働省. 臨床研究中核病院について.
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/tyukaku.html (2023年5月24日参照)
3)U.S. Food & Drug Administration. Framework for FDA’s Real-World Evidence Program. 2018.
https://www.fda.gov/media/120060/download (2023年5月24日参照)
4)European Medicines Agency. Use of patient disease registries for regulatory purposes - methodological and operational considerations. 2018-11-05.
https://www.ema.europa.eu/documents/other/discussion-paper-use-patient-disease-registries-regulatory-purposes-methodological-operational_en.docx (2023年5月24日参照)
5)独立行政法人 国立病院機構. 国立病院機構診療情報集積基盤について~電子カルテデータの標準化から利活用へ~
https://nho.hosp.go.jp/files/000145085.pdf (2023年5月24日参照)
6)Casulo C, et al. J Clin Oncol 2015; 33(23): 2516-2522.