HORIZON Expert Interview リアルワールドデータの現在地


日本における造血細胞移植データ収集の歩み
~国内データの一元化から国際研究に向けたハーモナイゼーションまで~
――リアルワールドデータ研究を中心に進歩した造血細胞移植
造血細胞移植は、薬物治療とは異なり、その実施は選択可能なドナーや幹細胞の供給に依存するため、重要なクリニカルクエスチョンをランダム化比較試験(RCT)により検証することが難しいといった特徴があります。そのため、移植医が症例を持ち寄り、その情報を蓄積し、分析・議論を深めるというリアルワールドデータ(RWD)を活用する文化が根付いてきた領域です1)。日本における造血細胞移植に関する調査は、小児科領域では1980年代から、日本骨髄移植研究会(後 日本造血細胞移植学会:JSHCT、現 日本造血・免疫細胞療法学会:JSTCT) による全国集計は1993年2)から開始され、世界的にも“疾患/患者レジストリ”という言葉が確立していない時代から、これまでRWDの収集と解析が続けられてきました。
――日本における造血細胞移植レジストリ一元化の取り組み
その一方で、造血細胞移植に関するレジストリの構築は、かつてはJSTCTのみならず、日本小児血液・がん学会や日本骨髄バンク、日本さい帯血バンクネットワークにおいても個別に行われていたことから、同一症例が複数のレジストリに重複登録されている、レジストリ毎に調査項目が異なるなどの問題が顕在化し、データ登録を行う医療機関の負担増大や、移植の全数把握を含めたデータ解析の障壁となっていました。そうしたなかで、日本における造血細胞移植の実施状況をより正確かつ効率的に把握することを目的に、これら4つのレジストリの一元化に向けたJSTCTデータ管理委員会ワーキンググループが2004年3月に発足し、調査項目の洗い出しや一元化、データを一元的に収集・管理する体制の構築が進められてきました。
2006年には、移植登録一元管理プログラム(Transplant Registry Unified Management Program: TRUMP®)がリリースされ、日本における造血細胞移植登録の電子化・一元化が実現する3, 4)と、2007年には、海外の造血細胞移植レジストリをもつCenter for International Blood and Marrow Transplant Research(CIBMTR、北米)、European Society for Blood and Marrow Transplantation(EBMT、欧州)との基本項目のハーモナイゼーションを行い、日欧米のデータを用いたグローバルな研究も可能となりました。
――日本造血細胞移植データセンターの設立と求められる役割
その後、さい帯血バンクの経営破綻などが社会問題化し、造血細胞移植を取り巻く環境の整備や規制が求められるようになったことで、2014年には「移植に用いる造血幹細胞の適切な提供の推進に関する法律」が施行5)されました。そのなかでは、造血細胞移植のデータ収集と解析が重要であること、この事業を国が支援することが明記されています。
そうしたなかで、日本造血細胞移植データセンター(JDCHCT)は、2013年にJSTCTから独立するかたちで設立6)され、以降JSTCTと共同で造血細胞移植に関するデータ収集・管理・解析を担ってきました。得られたデータを解説付きでまとめたスライド(日本語版・英語版)の作成を通じた一般市民への情報公開、さらに関連学会や国際機関などとともに、治療成績の向上を目指したデータの利活用を推進しています7)。
造血細胞移植レジストリとリアルワールドエビデンス
~医療機関や地域の壁を越えてRWEを生み出すしくみづくり~
――約12万症例、2,000超の調査項目を網羅したレジストリ
JSTCTとJDCHCTが運用する造血細胞移植レジストリは、全国400の診療科において登録される患者情報と、日本骨髄バンクやさい帯血供給事業者、日本赤十字社などから提供されるドナー情報を融合したデータベースです。現在、毎年5,500例以上の新規登録があり、2022年11月現在までに12万件弱の移植症例のデータが蓄積されました。新規移植症例については、2,000を超える項目を調査するのに加え、前年までの登録症例についても情報の更新を行うことで、フォローアップ情報も収集しています。JDCHCTでは、登録されたデータのクリーニング、一次解析、データセットの提供、研究・統計解析支援などを行ってきました(図1)8)。
図1|造血細胞移植レジストリの運用とRWDの利活用
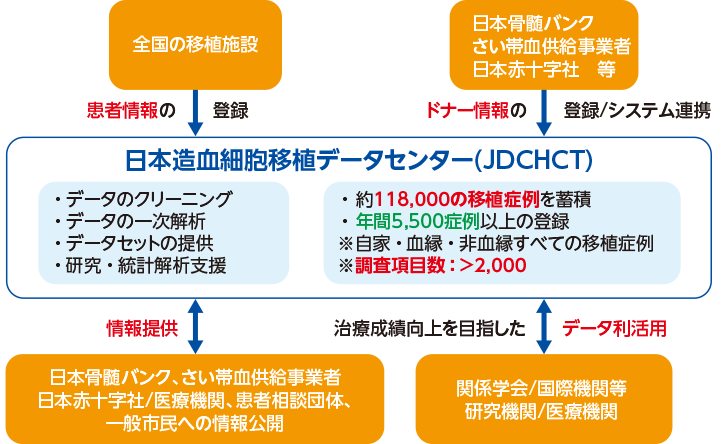
日本造血細胞移植データセンター 熱田 由子先生ご提供
日常診療や社会活動において自動的に生じる電子カルテデータとは異なり、疾患/患者レジストリでは、あらかじめ調査項目や定義を設定してデータを収集できることから、質の高いリアルワールドエビデンス(RWE)の創出が期待されます。造血細胞移植の場合、関係する疾患が多岐にわたり、移植の急性期から晩期にわたって多様な合併症が認められることから、そこには非常に多くのクリニカルクエスチョンが生まれます。これらクリニカルクエスチョンを解決するためには、多くの研究の実施が必要となりますが、リサーチクエスチョン毎にプロトコルを立てて、それらすべてに関して、全国の医療機関の実施承認を得ていくことは現実的ではありません。そこで、JSTCT/JDCHCTでは、この領域で求められるRWEのために必要な基本調査項目を定め、造血細胞移植レジストリとして運用することで、多くの研究に必要な情報の収集の効率化に取り組んできました9, 10, 11)。
――RWDからRWEを創出するためのしくみをオールジャパンで研究を推進
これまでに実施されたTRUMP®を用いたレジストリ研究は、国際的にも高く評価されており、2022年までに約500報の文献が出版されました。これらの研究成果は、RWEとして造血細胞移植に関連する各種ガイドラインに反映されるなど、治療の進歩に大きく貢献しています。
このようにRWDをRWE創出へとつなげていくためには、数多くの研究者の尽力が不可欠であり、さらに国の支援を受けて収集されたデータを適切に取り扱い、得られた結果を国民へと還元していくことも求められます。そこでJSTCTでは、2010年にレジストリ研究に関する横断的テーマのワーキンググループを開始12)し、現在、24のワーキンググループに、全国から400人を超える研究者が参加しています(表1)。本ワーキンググループには、データおよびその利活用を管理する委員会が設置されており、メンバーの募集、研究の承認や進捗管理などのルールを明文化し、透明性の高い運営が行われてきました。質の高いRWEを発信しつづけるうえでは、このように医療機関や地域といった壁を越えたオールジャパンでの取り組みが可能な環境・しくみを整えていくことも不可欠です。
表1|JSTCTワーキンググループ
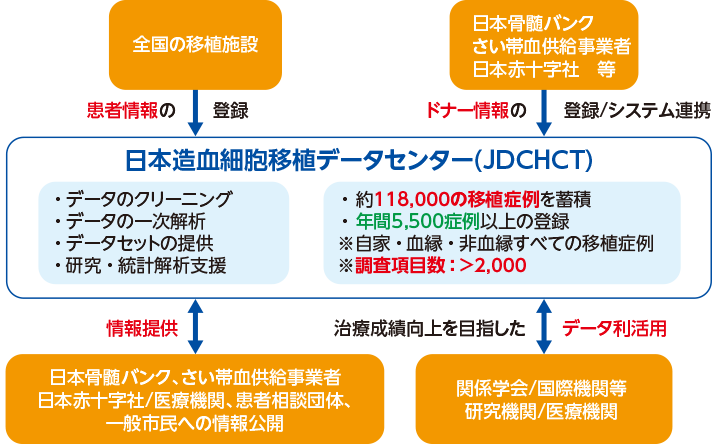
日本造血細胞移植データセンター 熱田 由子先生ご提供
日常診療や社会活動において自動的に生じる電子カルテデータとは異なり、疾患/患者レジストリでは、あらかじめ調査項目や定義を設定してデータを収集できることから、質の高いリアルワールドエビデンス(RWE)の創出が期待されます。造血細胞移植の場合、関係する疾患が多岐にわたり、移植の急性期から晩期にわたって多様な合併症が認められることから、そこには非常に多くのクリニカルクエスチョンが生まれます。これらクリニカルクエスチョンを解決するためには、多くの研究の実施が必要となりますが、リサーチクエスチョン毎にプロトコルを立てて、それらすべてに関して、全国の医療機関の実施承認を得ていくことは現実的ではありません。そこで、JSTCT/JDCHCTでは、この領域で求められるRWEのために必要な基本調査項目を定め、造血細胞移植レジストリとして運用することで、多くの研究に必要な情報の収集の効率化に取り組んできました9, 10, 11)。
――RWDからRWEを創出するためのしくみをオールジャパンで研究を推進
これまでに実施されたTRUMP®を用いたレジストリ研究は、国際的にも高く評価されており、2022年までに約500報の文献が出版されました。これらの研究成果は、RWEとして造血細胞移植に関連する各種ガイドラインに反映されるなど、治療の進歩に大きく貢献しています。
このようにRWDをRWE創出へとつなげていくためには、数多くの研究者の尽力が不可欠であり、さらに国の支援を受けて収集されたデータを適切に取り扱い、得られた結果を国民へと還元していくことも求められます。そこでJSTCTでは、2010年にレジストリ研究に関する横断的テーマのワーキンググループを開始12)し、現在、24のワーキンググループに、全国から400人を超える研究者が参加しています(表1)。本ワーキンググループには、データおよびその利活用を管理する委員会が設置されており、メンバーの募集、研究の承認や進捗管理などのルールを明文化し、透明性の高い運営が行われてきました。質の高いRWEを発信しつづけるうえでは、このように医療機関や地域といった壁を越えたオールジャパンでの取り組みが可能な環境・しくみを整えていくことも不可欠です。
表1|JSTCTワーキンググループ

日本造血・免疫細胞療法学会. ワーキンググループについて
https://www.jstct.or.jp/modules/about/index.php?content_id=10
(2023年6月23日閲覧)

日本造血・免疫細胞療法学会. ワーキンググループについて
https://www.jstct.or.jp/modules/about/index.php?content_id=10
(2023年6月23日閲覧)
現在進行中の新たな取り組みと今後の課題
――遺伝子改変T細胞療法に関する国際連携レジストリの構築、造血細胞移植レジストリから造血細胞移植と細胞治療のレジストリへ
新たな細胞治療として注目を集めるキメラ抗原受容体T(CAR-T)細胞療法は、近年、複数の製品が相次いで開発され、今後も他のがん種への適応拡大や、多様な標的を有するCAR-T製品の上市、健康ドナー由来のCAR-T細胞を用いたuniversal CAR-T細胞といった新規治療の検討も進められています。そうしたなかで、CAR-T療法を扱うアカデミアやグローバル企業において、国際的なレジストリを用いたRWD解析のニーズも高まってきました。
JDCHCTの運用する造血細胞移植・細胞治療レジストリでは、従来から基本項目に関して海外レジストリとのハーモナイゼーションを行ってきましたが、CAR-T細胞療法に関する項目については、CIBMTR、EBMTとのデータシェアリングを視野に、CIBMTRのWebシステムFormsNet3日本語版の調査票(フォーム)を導入しました13)。なお、日本のデータはJSHCT/JDCHCTの利活用ルールに基づき、CIBMTRのレジストリとは独立したかたちで運用されています。CIBMTRとは、レジストリ間のデータシェアリングの合意形成がなされており、国際共同研究にあたっては、双方からの立案が可能な研究の立案と承認プロセスを両者で構築中です。また、先ほど紹介したJSTCTのワーキンググループにおいても、新たにCAR-T療法などを扱う細胞治療グループが立ち上げられましたが、当初から100人を超える応募者が集まるなど高い注目を集めており、今後の研究の進展や国際連携から、新たなRWEが創出されることを期待しています。
RWDの利活用の推進に向けた制度やシステムの発展
~RWDを活かした効率的な製造販売後調査が広がりつつある~
――早期承認制度の開始とその有効性・安全性評価
近年の新規薬剤・医療機器開発コスト高騰などを背景に、RWD研究を新規薬剤の承認や製造販売後調査に活用するという取り組みも、国内外で積極的に進められてきました。
日本においても、2005年に日米EU医薬品規制調和国際会議(ICH)のE2Eガイドライン「医薬品安全性監視の計画」の策定14)や、2014年には「再生医療等製品の条件及び期限付き承認制度」が制定15)されたことなどを背景に、効率的な創薬のための環境が整備されています。その1つがクリニカル・イノベーション・ネットワーク(CIN)であり、学会などが構築する疾患登録システムをネットワーク化し、疾患登録制度を活用した効率的な治験・製造販売後調査・臨床研究を推進することを目的としています。また、2018年には、医薬品医療機器総合機構(PMDA)にレギュラトリーサイエンスセンターが設置16)され、RWDを活用した承認審査や安全対策の質の向上、外部機関との連携によるレギュラトリーサイエンスの推進も図られてきました。
さらに、2017年には対象を拡大した条件付き早期承認制度の運用17)も開始されており、有効性が推定され、安全性が認められれば、特別に早期に条件および期限を付して承認を受けられる一方、本制度の適用を受けた医薬品は、有効性・安全性を確認するためのRWDの収集と解析の実施が条件として課されています。
――造血細胞移植・細胞治療レジストリを活用した産官学共同による製造販売後データベース調査
こうしたRWD利活用が推進される一方で、RWD収集に伴うデータベースの構築やデータ入力などの負担は大きく、また別々に構築されたデータベース間でのデータの統合や解析は、症例の重複や登録項目の相違などから容易ではありません。こうした状況を背景に、2018年に改正された「医薬品の製造販売後の調査及び試験の実施の基準に関する省令」では、製造販売後調査の調査区分として「製造販売後データベース調査」が新たに設定18)され、既存の医療情報データベースを利用した検討も可能となりました。
そうしたなか、JDCHCTでは造血細胞移植・細胞治療レジストリを、製造販売後調査(製薬企業)・再生医療等製品患者登録システム(厚生労働省/PMDA)として活用する産官学共同の試みを進めてきました。すでに複数の製剤の製造販売後データベース調査に活用されており、今後、その範囲はさらに広がるものと考えています。
――レジストリ構築と運用における負担軽減や人材育成の推進
このように造血細胞移植・細胞治療レジストリを中心としたRWD収集とそこから得られたRWEは、この領域の治療の進歩に大きく貢献してきましたが、その背景にはデータ登録にあたって全国の医療機関における多大な尽力があることを忘れてはいけません。患者/疾患レジストリは、RWDとして位置づけられていますが、日常診療や社会活動において自動的に生じるデータではありません。近年、RWDに注目が集まることで、レジストリ研究には大きな期待が寄せられていますが、こうした医療機関の負担にも焦点を当てながら研究を進めていくことが重要だと思います。
また、データサイエンスの重要性が叫ばれるなかでは、人材の育成やスタッフ雇用のための予算確保を真剣に考えていく必要もあります。医師が日常診療の合間にデータ入力を行うといった状況は改善すべき点であり、今後検討が求められるところです。
私たちが近年進めてきた産官学共同での製造販売後データベース調査では、各薬剤の有効性や安全性に関するRWEを明らかにできるのみならず、共通のレジストリを用いた調査を行うことで、個別の薬剤のRWE創出にとどまらず、類似薬同士での治療アウトカムを比較することもできるようになるなど、RWD研究の可能性はさらに広がりつつあります。私たちも、そうした将来を見据えながら、レジストリの構築・運用を進めていきたいと考えています。
1)Aljurf M, et al. Bone Marrow Transplant 2014; 49(8): 1016-1021.
2)厚生労働省. 造血細胞移植一元化登録データを用いた登録研究について
https://www.mhlw.go.jp/file/05-Shingikai-11121000-Iyakushokuhinkyoku-Soumuka/0000013475.pdf(2023年6月23日アクセス)
3)熱田由子, 他. 臨床血液 2007; 48(11): 1462-1469.
4)Atsuta Y, et al. Int J Hematol 2007; 86(3): 269-274.
5)厚生労働省. 移植に用いる造血幹細胞の適切な提供の推進に関する法律」の施行後の状況等について(2019年11月28日)
https://www.mhlw.go.jp/content/10900000/000572140.pdf(2023年6月23日アクセス)
6)日本造血細胞移植データセンター. センター概要
http://www.jdchct.or.jp/outline/(2023年6月23日アクセス)
7)Kanda Y. Int J Hematol 2016; 103(1): 1-2.
8)熱田由子. 日本造血細胞移植学会雑誌 2021; 10(1): 1-6.
9)Atsuta Y. Int J Hematol 2016; 103(1): 3-10.
10)Kanda J. Int J Hematol 2016; 103(1): 11-19.
11)熱田由子. 臨床血液 2020; 61(4): 387-391.
12)日本造血・免疫細胞療法学会. ワーキンググループについて
https://www.jstct.or.jp/modules/about/index.php?content_id=10(2023年6月23日アクセス)
13)Atsuta Y, et al. Japanese Journal of Transplantation and Cellular Therapy 2022; 11(4): 193-198.
14)厚生労働省. 医薬品安全性監視の計画について (2005年9月16日)
https://www.mhlw.go.jp/shingi/2009/12/dl/s1214-13i.pdf(2023年6月23日アクセス)
15)独立行政法人医薬品医療機器総合機構. 再生医療等製品: 条件及び期限付き承認ー条件をクリアするために-(2014年11月25日)
https://www.pmda.go.jp/files/000199506.pdf(2023年6月23日アクセス)
16)独立行政法人医薬品医療機器総合機構. レギュラトリーサイエンスセンターについて
https://www.pmda.go.jp/rs-std-jp/rs-center/0001.html(2023年6月23日アクセス)
17)厚生労働省. 医薬品の条件付き早期承認制度について 第3回医薬品医療機器制度部会 資料2(2017年11月15日)
https://www.mhlw.go.jp/file/05-Shingikai-10601000-Daijinkanboukouseikagakuka-Kouseikagakuka/0000184922.pdf(2023年6月23日アクセス)
18)独立行政法人医薬品医療機器総合機構. 医療情報データベースを活用した医薬品の製造販売後調査について(2018年9月29日)
https://www.pmda.go.jp/files/000226165.pdf(2023年6月23日アクセス)