ビプリブ点滴静注用400単位 発売中
ベラグルセラーゼ アルファ(遺伝子組換え)
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
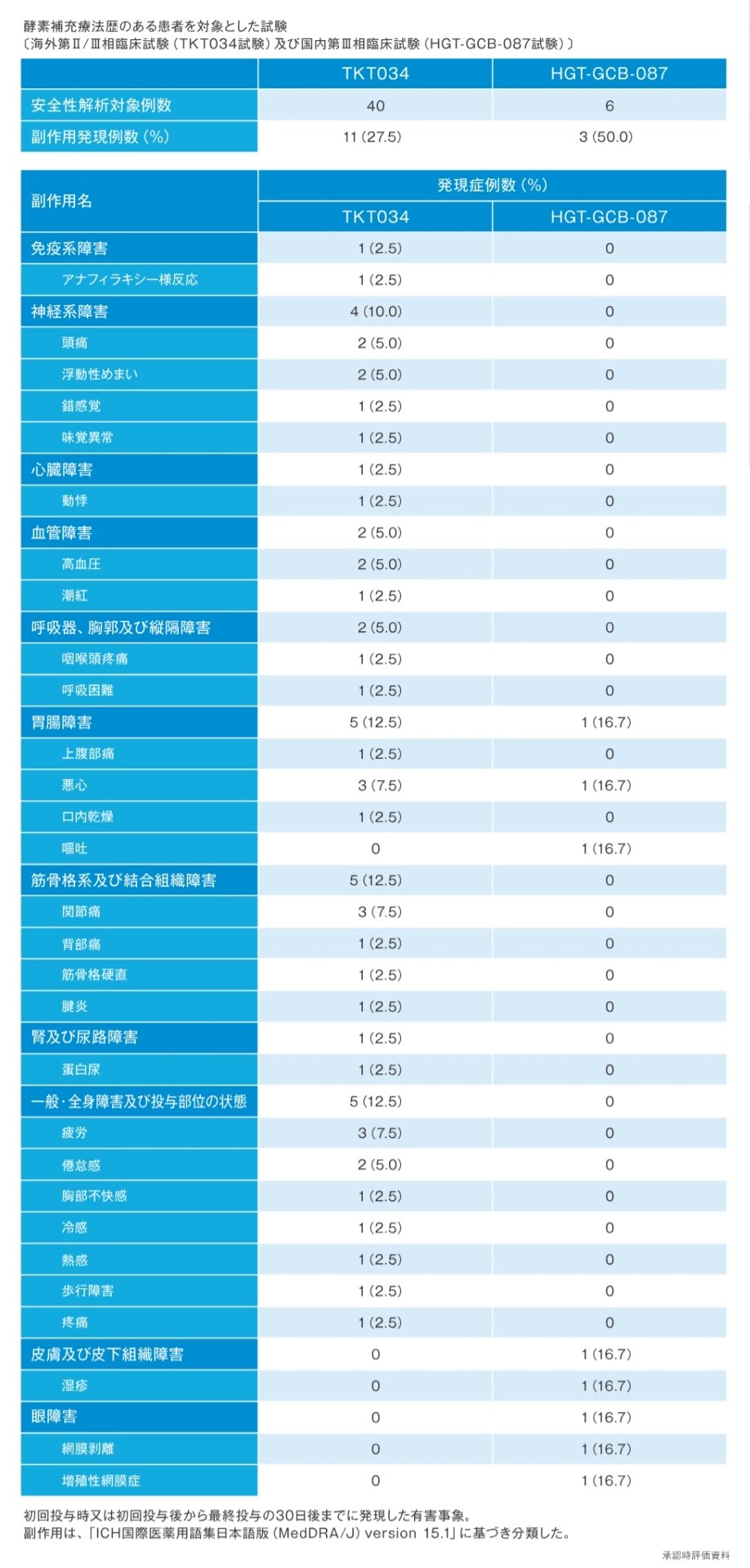
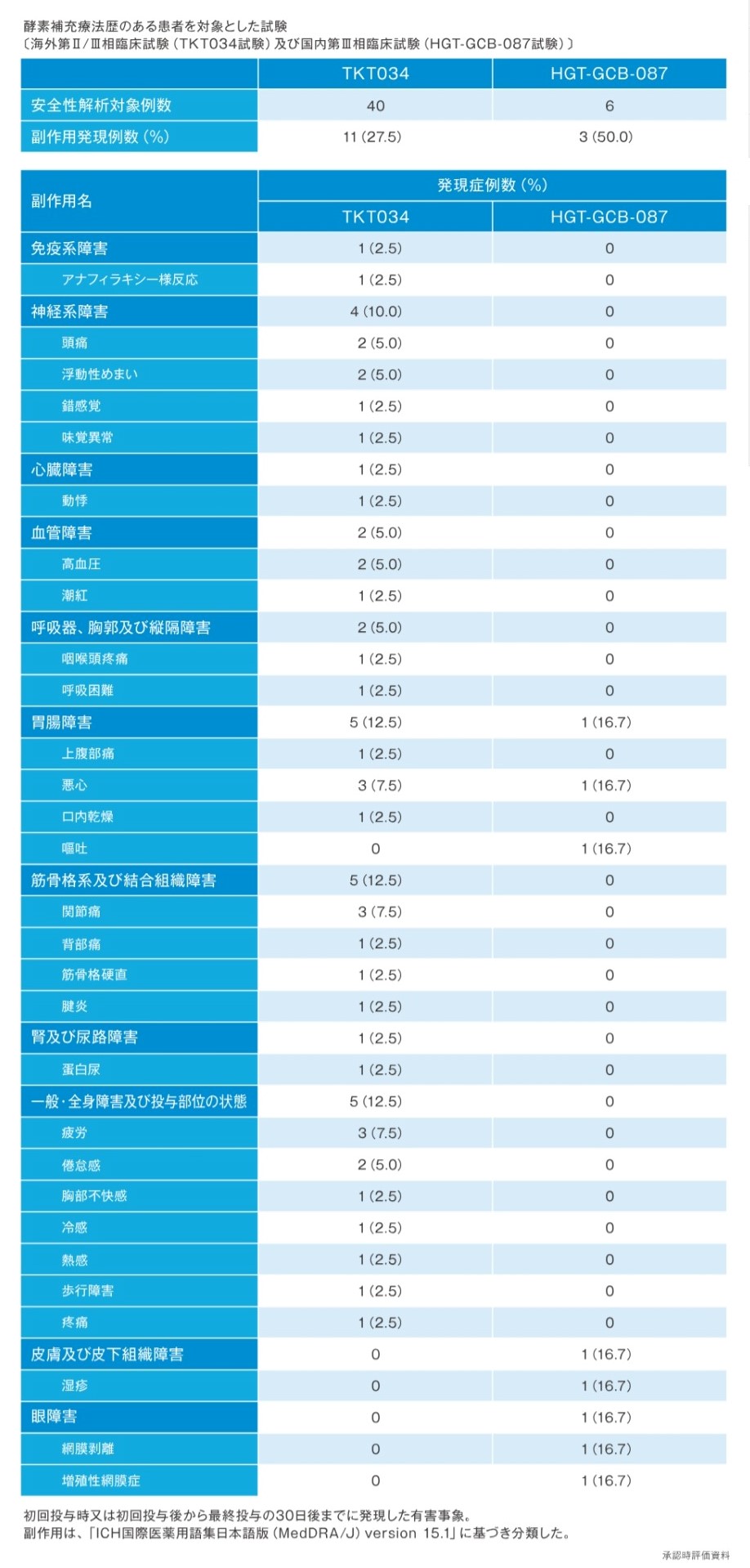
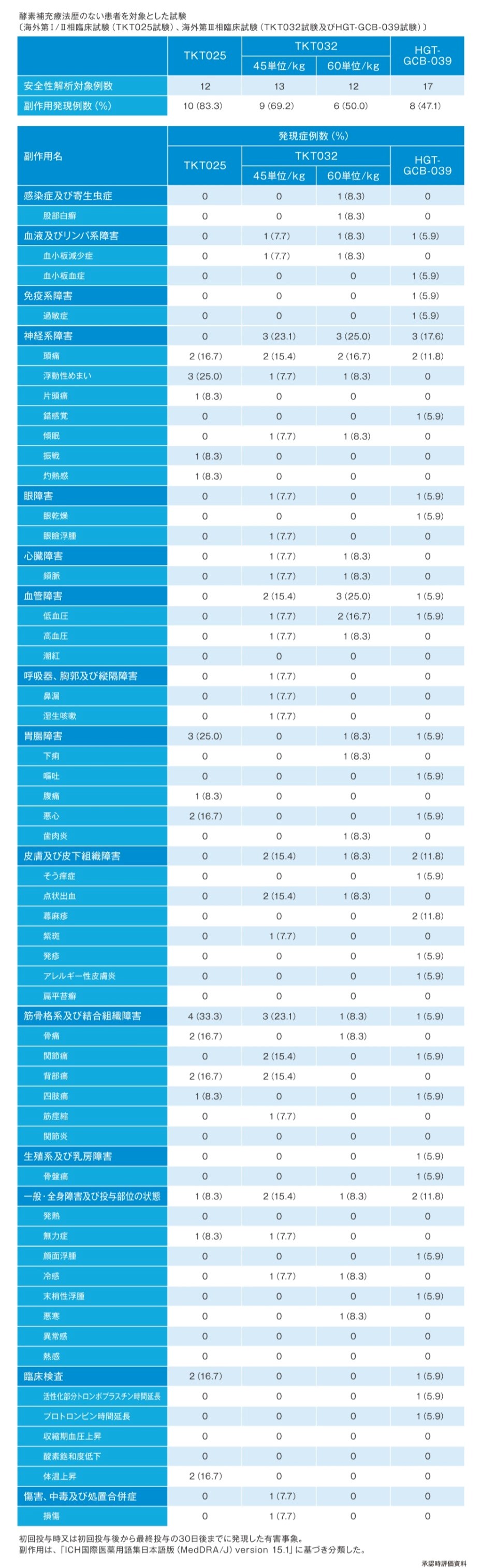
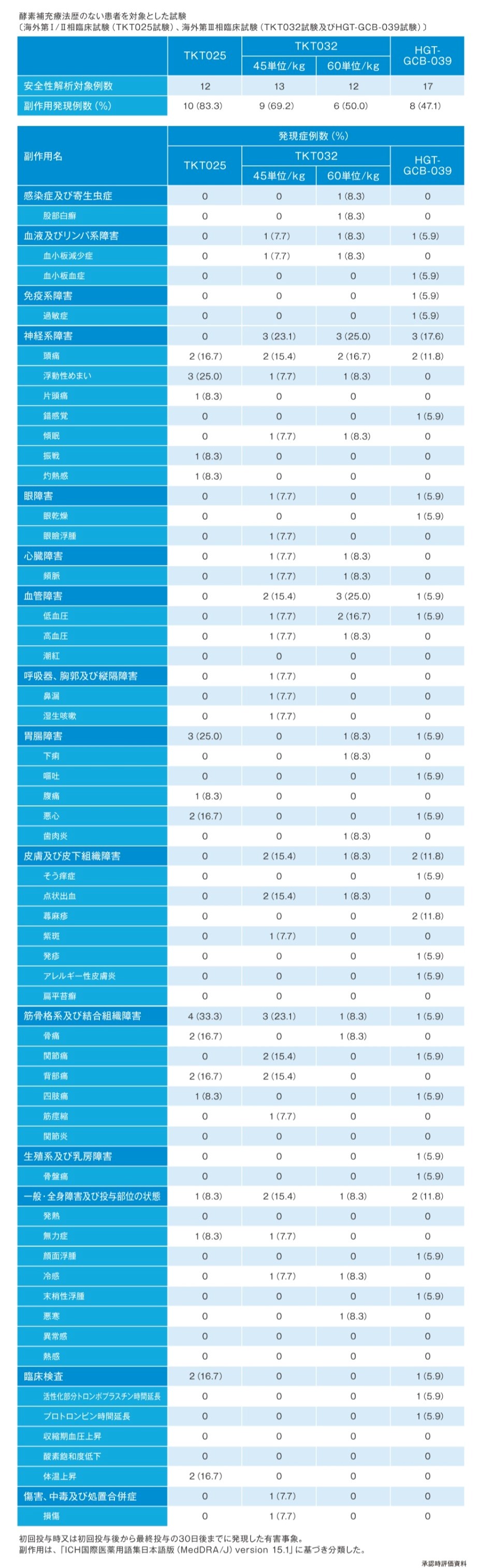
ビプリブの安全性
- 国内第Ⅲ相臨床試験(HGT-GCB-087試験1))において、本剤を投与した6例中3例(50.0%)に副作用が認められた。副作用の内訳は、悪心/嘔吐、湿疹、網膜剥離/増殖性網膜症(各1例(16.7%))であった。Infusion reactionは1例(16.7%)に認められた。
- 海外臨床試験(海外第Ⅰ/Ⅱ相臨床試験:TKT025試験2)、海外第Ⅲ相臨床試験(TKT032試験3)・HGT-GCB-039試験4))及び海外第Ⅱ/Ⅲ相臨床試験:TKT034試験5))において、本剤を投与した94例中44例(46.8%)に副作用(臨床検査値異常変動を含む)が認められた。主な副作用は、頭痛10例(10.6%)、浮動性めまい7例(7.4%)、関節痛6例(6.4%)、悪心6例(6.4%)、背部痛5例(5.3%)等であった。Infusion reactionは37例(39.4%)に認められた。(承認時)
- 重篤な有害事象は、HGT-GCB-087試験1)で網膜剥離1例、TKT032試験3)で60単位/㎏群において大発作痙攣1例、HGT-GCB-039試験4)で本剤群において3例(血小板減少症、痙攣、アレルギー性鼻炎で各1例)、TKT034試験5)で4例(アナフィラキシー様反応、顔面腫脹及び蕁麻疹、薬物過敏症、関節痛で各1例)に認められた。TKT025/TKT025EXT試験2)、HGT-GCB-044試験6)においては認められなかった。
- 投与中止に至った有害事象は、TKT034試験5)で1例(アナフィラキシー様反応)に認められた。HGT-GCB-087試験1)、TKT025/TKT025EXT試験2)、TKT032試験3)、HGT-GCB-039試験4)、HGT-GCB-044試験6)においては認められなかった。
- 死亡に至った有害事象はHGT-GCB-044試験6)で本剤群において死亡例1例(痙攣)が認められたが、治験薬との関連はなく、ゴーシェ病の進行に関連すると判断された。HGT-GCB-087試験1)、TKT025/TKT025EXT試験2)、TKT032試験3)、HGT-GCB-039試験4)、TKT034試験5)においては認められなかった。
1)承認時評価資料(国内第Ⅲ相臨床試験:HGT-GCB-087試験)
2)承認時評価資料(海外第Ⅰ/Ⅱ相臨床試験:TKT025/025EXT試験)
3)承認時評価資料(海外第Ⅲ相臨床試験:TKT032試験)
4)承認時評価資料(海外第Ⅲ相臨床試験:HGT-GCB-039試験)
5)承認時評価資料( 海外第Ⅱ/Ⅲ相臨床試験:TKT034試験)
6)承認時評価資料( 海外第Ⅲ相継続試験:HGT-GCB-044試験)
詳細は最新の電子添文をご参照ください。
画像(PC)
画像(SP)
画像(PC)
画像(SP)
画像(PC)

本文
画像(SP)

本文