ビプリブ点滴静注用400単位 発売中
ビプリブについて
ビプリブは、ヒト細胞株由来の酵素製剤でありアミノ酸配列はヒトグルコセレブロシダーゼと同一です。
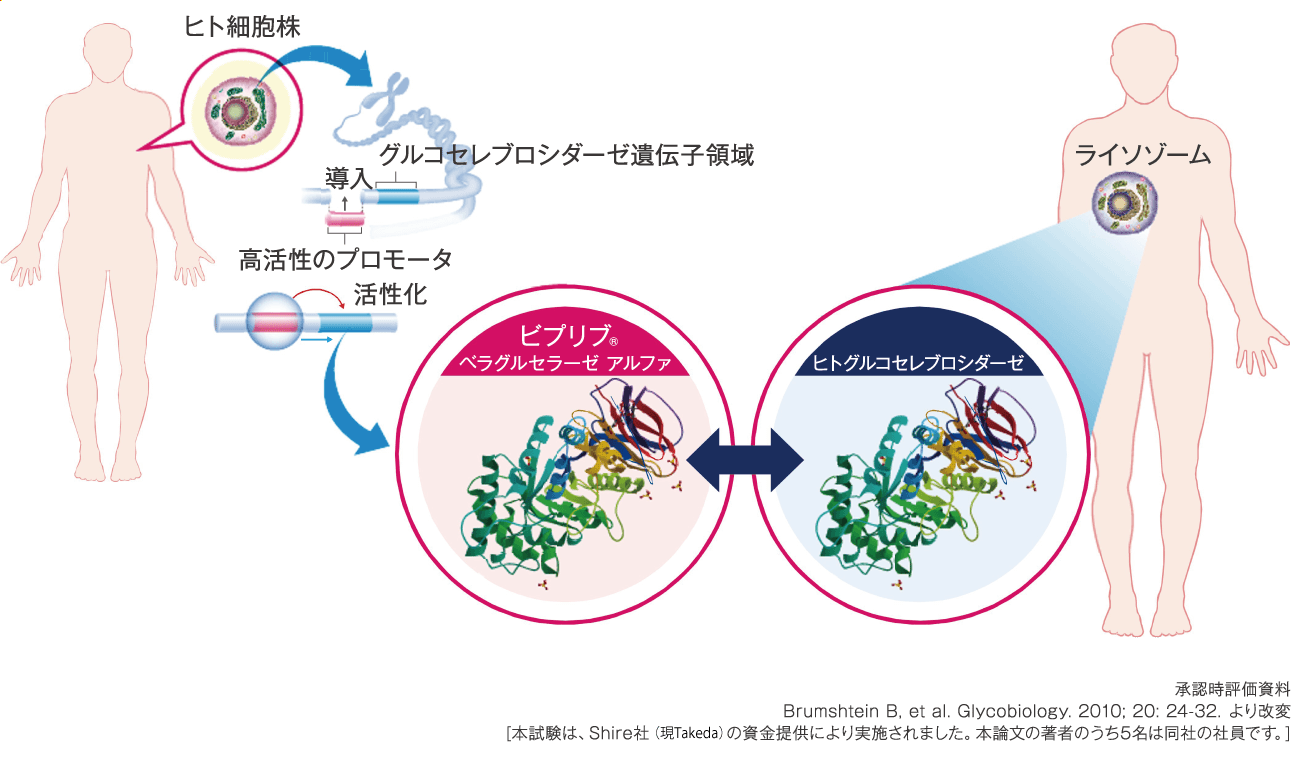
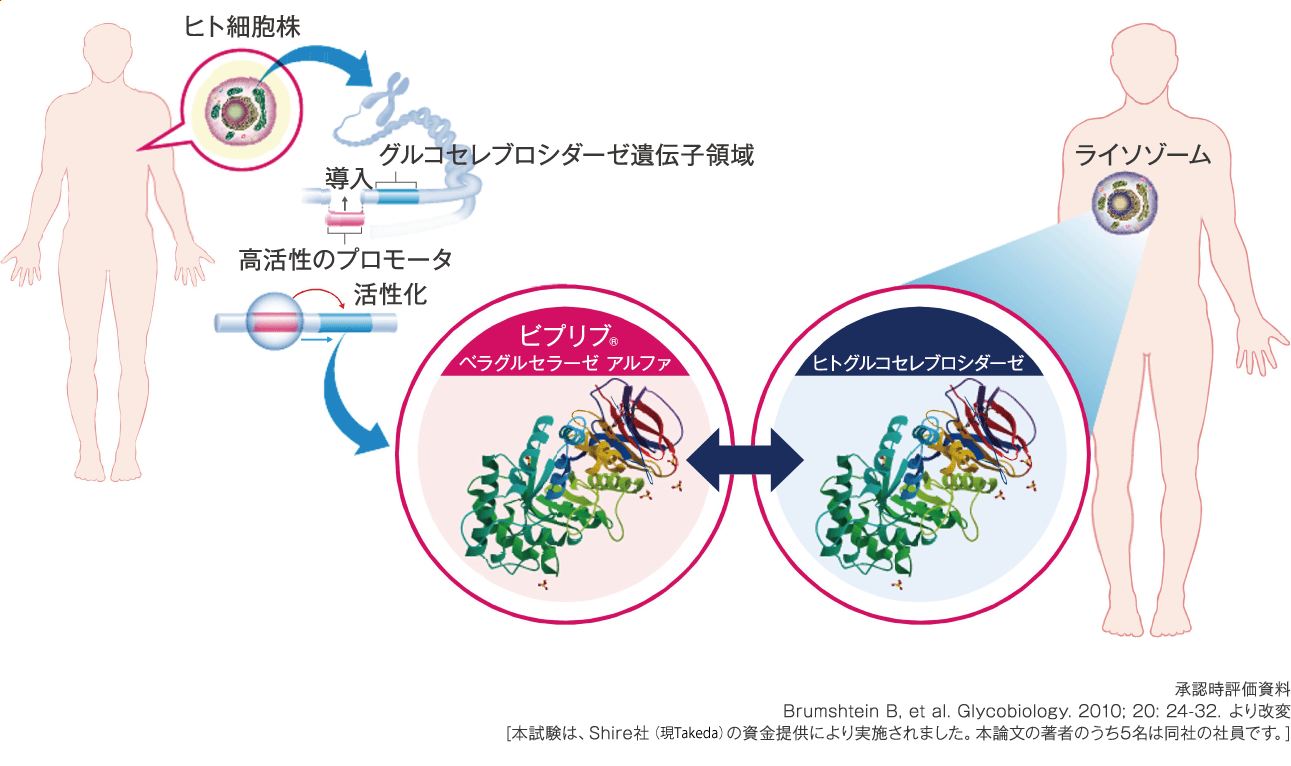
酵素製剤は、マンノース受容体を介してマクロファージに取込まれます。
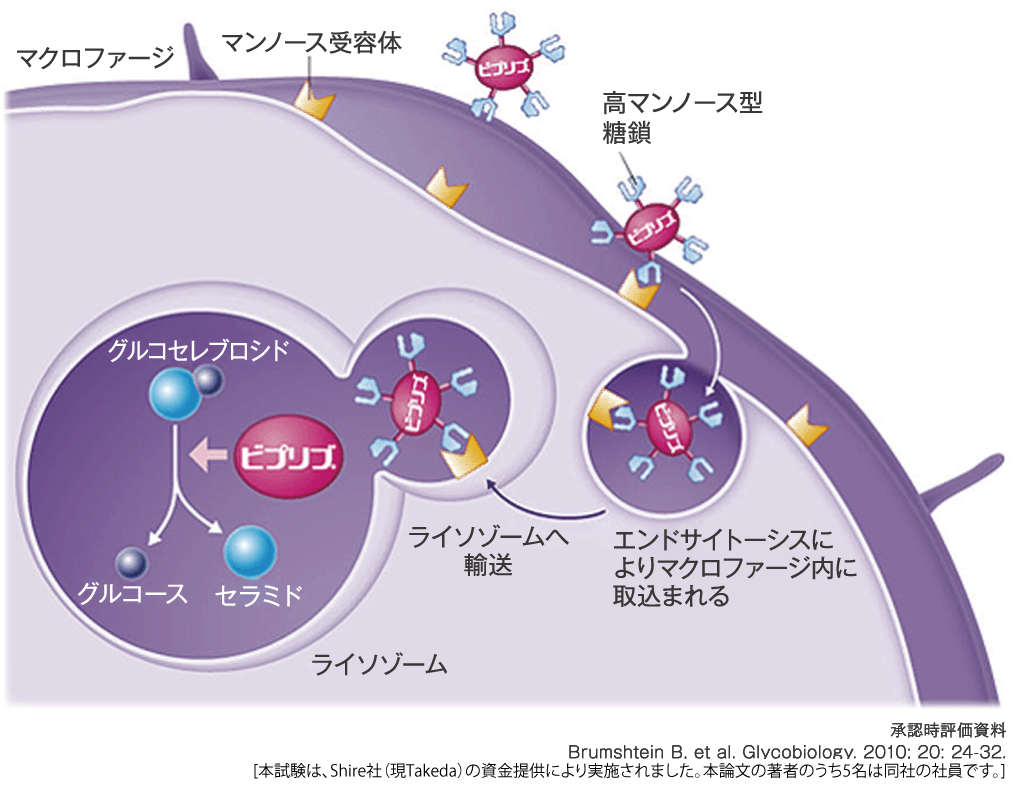
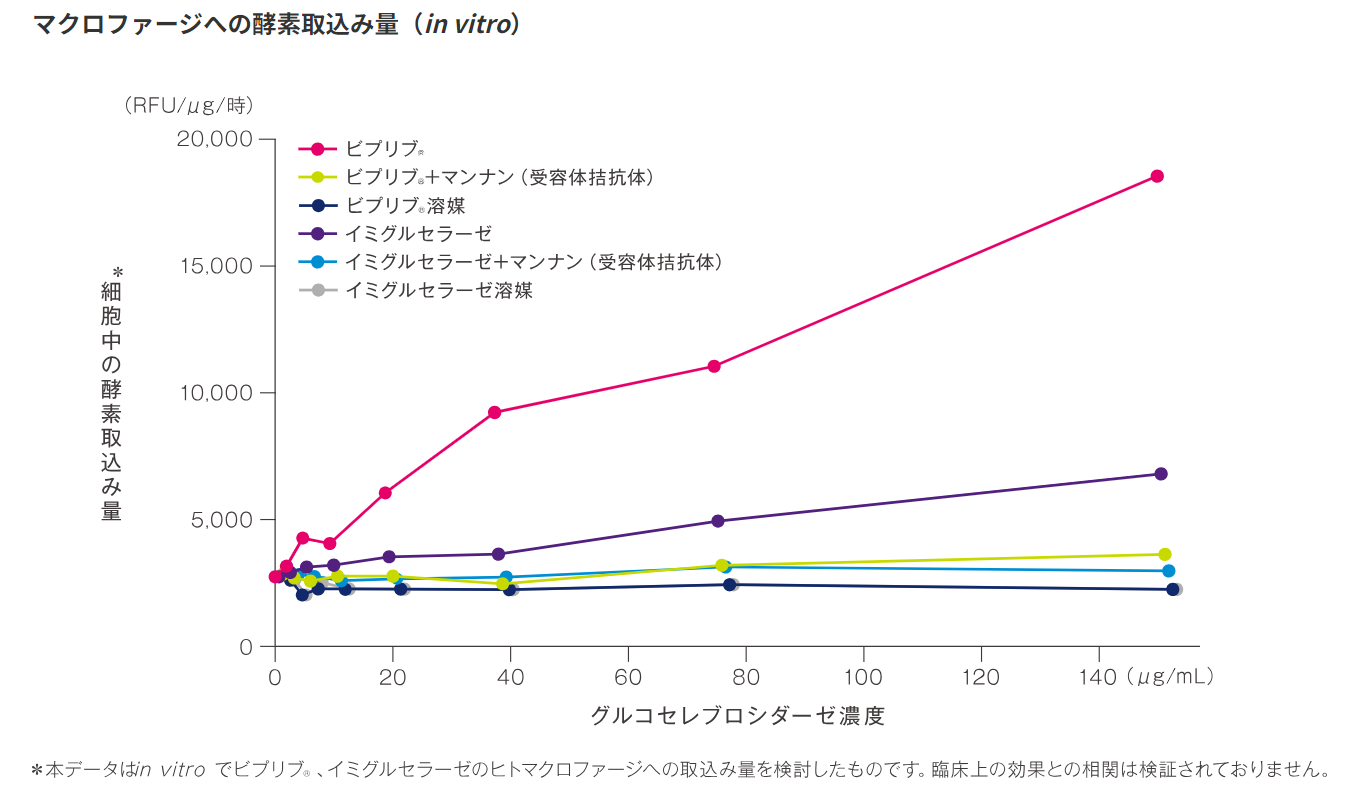
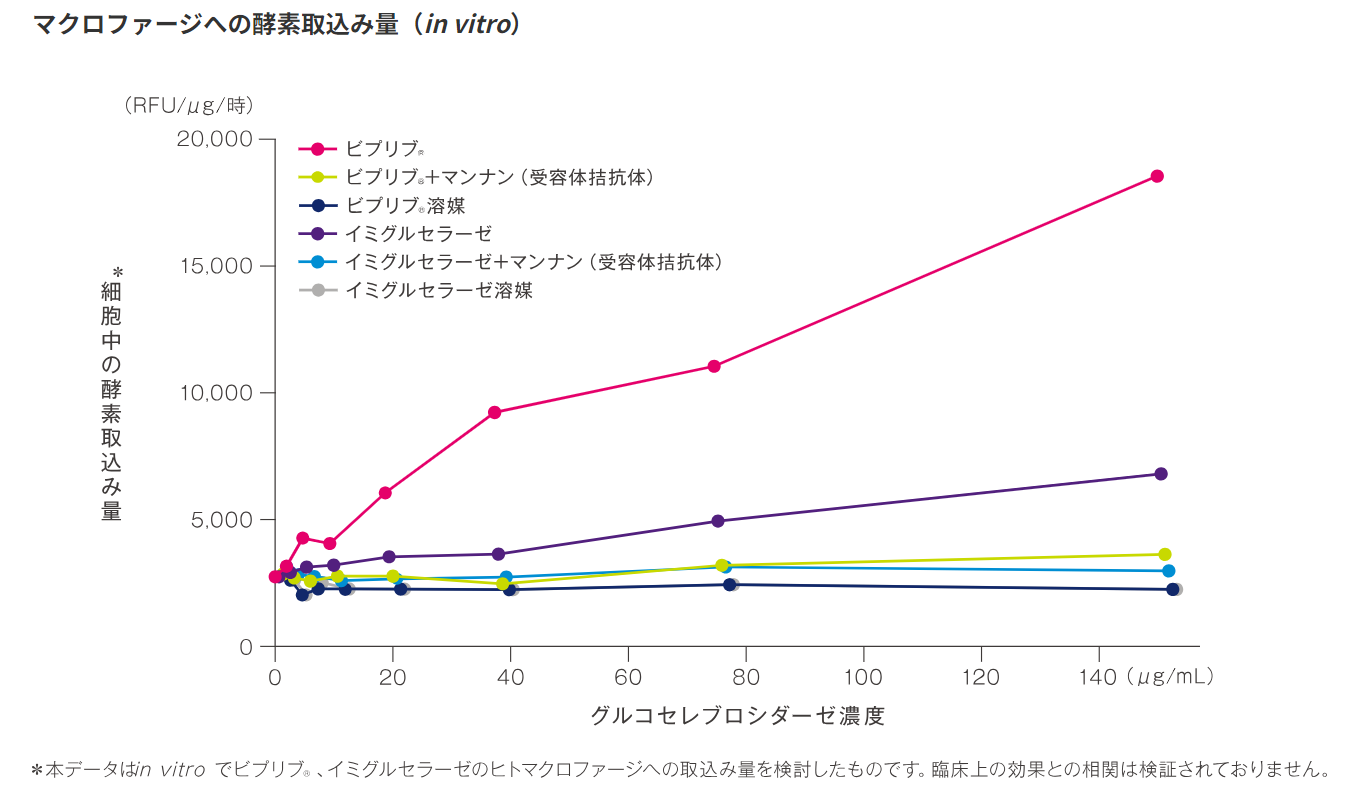
ビプリブ®は、高マンノース型糖鎖を有し、ヒトマクロファージへの取込みは他の酵素製剤と比べ最大約2.5倍でした(in vitro)。
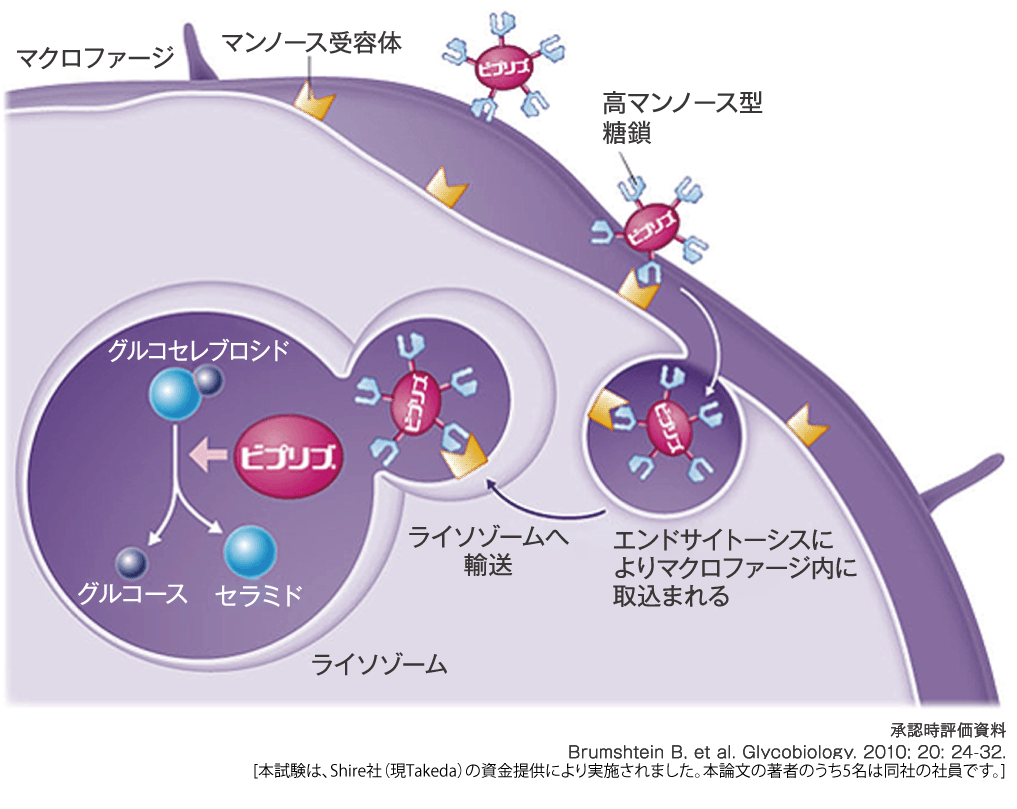
ビプリブ®は、高マンノース型糖鎖を有し、ヒトマクロファージへの取込みは他の酵素製剤と比べ最大約2.5倍でした(in vitro)。
試験概要
ヒトリンパ腫由来U937細胞をPhorbol Myristate Acetate(PMA)刺激で誘導したマクロファージに各種酵素〔ビプリブ(遺伝子組換え)、イミグルセラーゼ(遺伝子組換え)、マンナン添加により酵素阻害を加えた酵素〕を加え、3時間のインキュベーション後、細胞内への酵素の取込みを蛍光測定法により測定した※。
※細胞を溶解し、酵素反応によって蛍光を発する合成基質(4-MU-glc)を用いて酵素活性を測定し、総たん白質量あたりおよび反応時間でアッセイシグナルを正視化して「細胞中の酵素取込み量(RFU/μg/時)」とした。
承認時評価資料
Brumshtein B, et al. Glycobiology. 2010; 20: 24-32. より改変
[本試験は、Shire社(現Takeda)の資金提供により実施されました。本論文の著者のうち5名は同社の社員です。]
海外コア試験(025試験、032試験、039試験、034試験)におけるビプリブのIgG抗体産生は94例中1例(1%)でした(海外データ)。国内第Ⅲ相臨床試験におけるビプリブのIgG抗体産生は6例中0例でした。
承認時評価資料
pH7.0における野生型グルコセレブロシダーゼ(GC)の酵素活性は8.1単位/mg、イミグルセラーゼの酵素活性は4.0単位/mgで、野生型GCの酵素活性はイミグルセラーゼの2.0倍であることが示されました。
Sawkar A R, et al. ACS Chemical Biology. 2006; 1(4): 235‒251.
臨床成績
未治療における臨床パラメータの臨床効果
未治療のⅠ型ゴーシェ病患者を対象とした海外長期投与試験(HGT-GCB-044試験)において、4年後の治療目標達成率*は、血小板数では100%、脾臓容積では100%の患者が治療目標を達成し、ヘモグロビン値では97%、肝臓容積では96%の患者が治療目標を達成しました。
*本試験における治療目標
ヘモグロビン値: ヘモグロビン濃度の増加 12歳超の男性(≧12g/dL)、女性または12歳以下(≧11g/dL)
血小板数: ◇脾臓摘出されていない場合
2年以降、
・ベースラインが60×109/L未満の場合は100%以上増加・ベースラインが60×109/L以上、120×109/L未満の場合は100×109/L以上
・ベースラインが120×109/L以上の場合は120×109/L以上
◇脾臓摘出している場合
120×109/L以上肝臓容積: 3年目以降ベースラインから30%以上の減少もしくは正常の1.5倍以下
脾臓容積: 2年以降ベースラインから50%以上減少または正常の8倍以下
BMD: 3年以降Zスコアの変化 18歳以上(>0)
未治療のⅠ型ゴーシェ病患者を対象とした海外臨床試験(TKT025/TKT025EXT試験)において、臨床パラメータが検討されました。
ヘモグロビン濃度: 投与48ヵ月後の変化率は21.7%と、ベースラインから有意に増加した(P<0.004、対応のあるt検定)
血小板数: 投与48ヵ月後の変化率は157.8%と、ベースラインから有意に増加した(P<0.004、対応のあるt検定)
肝臓容積: 投与48ヵ月後の変化率は−42.8%と、ベースラインから有意に減少した(P<0.004、対応のあるt検定)
脾臓容積: 投与48ヵ月後の変化率は−79.3%と、ベースラインから有意に減少した(P<0.004、対応のあるt検定)
未治療のⅠ型ゴーシェ病患を対象とした海外臨床試験(TKT025/TKT025EXT試験)において、骨症状の契機となるゴーシェ細胞の骨髄浸潤を評価する腰椎BMBスコアの中央値は、ビプリブ投与開始9ヵ月後に−2、3年後に−5、7年後に−5となりました。
既治療における臨床効果
他剤で治療中のゴーシェ病患者において、ビプリブに切り替え後12ヵ月時点におけるベースラインから臨床パラメータが改善した患者の割合は、ヘモグロビン値が4/17例(23.5%)、血小板数6/17(35.3%)、肝臓容積6/17(35.3%)脾臓容積5/10例(50%)でした。
国内第Ⅲ相臨床試験(HGT-GCB-087試験)では、他剤で治療中のゴーシェ病患者6例を対象にビプリブに切り替え、投与51週目におけるベースラインからの変化量の中央値は、ヘモグロビン値 −0.05g/dL、血小板数 −6.2×109/L、肝臓容積 +0.75%、脾臓容積 +2.65%でした。
成人患者2例の51週後のベースラインからの腰椎Zスコアの変化量はそれぞれ−0.11、0.01、大腿骨頸部Zスコアの変化量は0.13、0.06でした。また、小児患者4例における51週後のベースラインからの骨年齢のZスコアの変化量はそれぞれ0、4.97、1.82、0.35、身長のZスコアの変化量は−0.330、−0.192、−0.120、−0.409でした。
安全性
重大な副作用として、infusion reaction(本剤投与中又は24時間以内に発現する本剤と関連する反応)でアナフィラキシーをおこすことがあります( 頻度不明)。主な副作用は、頭痛、浮動性めまい、悪心、関節痛、背部痛(いずれも5%以上)が報告されました。
詳細は電子添文の副作用及び各臨床成績の安全性の結果をご参照ください。

